由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。应用如下图所示电解实验可制得白色纯净的Fe(OH)2沉淀。两电极的材料分别为石墨和铁。
(1)a电极材料应为________________________________________,电极反应式为
_______________________________________________________;
(2)电解液c可以是(填编号)( )
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用为______________________________________________________,在加入苯之前对c应作怎样的简单处理?
______________________________________________。
(4)为了在较短时间内看到白色沉淀,可采取的措施(填编号)( )
A.改用稀硫酸作电解液
B.适当增大电源的电压
C.适当减少两电极间距离
D.适当降低电解液的温度
(5)若c为Na2SO4溶液,当电解一段时间看到白色Fe(OH)2沉淀后,再反接电源电解,除了电极上看到气泡外,混合物中另一明显现象为________________________________。
测定硫酸铜晶体(CuSO4·5H2O)里结晶水的含量,实验步骤为:①研磨 ②称量空坩埚和装有试样的坩埚的质量 ③加热 ④冷却 ⑤称量⑥重复③至⑤的操作,直到连续两次称量的质量差不超过0.1 g为止 ⑦根据实验数据计算硫酸铜晶体里结晶水的含量。
请回答下列问题:
(1)现有坩埚、坩埚钳、三脚架、泥三角、玻璃棒、干燥器、药匙、硫酸铜晶体样品等实验用品,进行该实验时,缺少的实验用品是
____________________________________________。
(2)该实验中哪一步骤需要使用干燥器?使用干燥器的目的是什么?答:
____________________________________________。
(3)实验步骤⑥的目的是________________________________________________________。
(4)若操作正确而实验测得的硫酸铜晶体中结晶水的含量偏低,其原因可能有(填入选项的编号):_______________________。
| A.被测样品中含有加热不挥发的杂质 | B.被测样品中含有加热易挥发的杂质 |
| C.实验前被测样品已有部分失水 | D.加热前所用的坩埚未完全干燥 |
某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)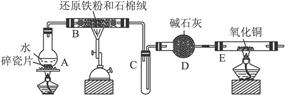
(1)装置B中发生反应的化学方程式是________________________________________。
(2)装置E中的现象是______________________________________________________。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法:___________________________________________________。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下: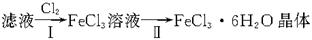
①步骤Ⅰ中通入Cl2的作用是___________________________________________________。
②步骤Ⅱ从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:_________________。
③该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)_______________。
为除去粗盐中的Ca2+、Mg2+、Fe3+、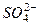 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):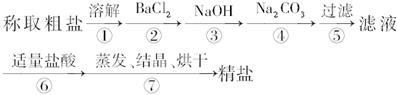
(1)判断BaCl2已过量的方法是______________________________________。
(2)第④步中,相关的离子方程式是_____________________________________。
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是
__________________________________________________。
(4)为检验精盐纯度,需配制150 mL 0.2 mol·L-1 NaCl(精盐)溶液,上图是该同学转移溶液的示意图,图中的错误是______________________________________。
工业上为了处理含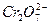 离子的酸性废水,采用以下处理方法:
离子的酸性废水,采用以下处理方法:
①往工业废水中加入适量食盐。
②以铁作为阳极进行电解。
③鼓入空气。经过一段时间后,使废水中含铬量降到可排放的标准。
请用已学过的化学知识解释处理含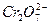 离子的工业废水的原因。
离子的工业废水的原因。
注:Fe(OH)3开始沉淀的pH为2.7,沉淀完全的pH为3.7。Fe(OH)2开始沉淀的pH为7.6,沉淀完全的pH为9.6,并且Fe(OH)2呈絮状沉淀,不易从溶液中除去。
(10分)下图是硫酸试剂瓶标签上的内容:
(1)该硫酸的物质的量浓度为________ mol·L-1。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要240 mL 4.6 mol·L-1的稀H2SO4,则需取________ mL的该硫酸,将上述硫酸进行稀释的实验操作为
________________________________________________________________________。
(3)在配制4.6 mol·L-1的稀H2SO4的过程中,下列情况对硫酸溶液物质的量浓度有何影响(填“偏高”“偏低”或“无影响”)
①未经冷却趁热将溶液注入容量瓶中:________;
②容量瓶用1 mol·L-1的稀H2SO4润洗:________;
③定容时俯视液面读数:________。
(8分)选择下列实验方法分离物质,将分离方法的序号填在横线上。
| A.萃取分液 | B.升华 | C.结晶 | D.分液 E.蒸馏 F.过滤 |
(1)________分离饱和食盐水与沙子的混合物。
(2)________从硝酸钾和氯化钠的混合液中获得硝酸钾。
(3)________分离水和汽油的混合物。
(4)________分离CCl4(沸点为76.75 ℃)和甲苯(沸点为110.6 ℃)的混合物。
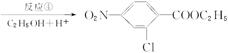
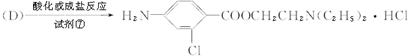
氯普鲁卡因盐酸盐是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:
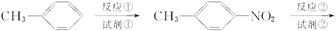
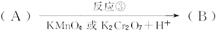
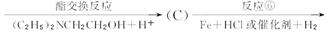
 (氯普鲁卡因盐酸盐)
(氯普鲁卡因盐酸盐)
请把相应反应名称填入下表中,供选择的反应名称如下:
氧化、还原、硝化、磺化、氯代、酸化、碱化、成盐、酯化、酯交换、水解
| 反应编号 |
① |
② |
③ |
④ |
⑥ |
| 反应名称 |
|
|
|
|
|
(6分)如下图所示的装置,在盛有水的烧杯中,铁圈和银圈的相接处吊着一根绝缘的细丝,使之平衡。小心地从烧杯中央滴入CuSO4溶液。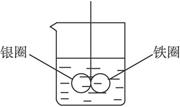
(1)片刻后可观察到的现象是_________ (指悬吊的金属圈)。
| A.铁圈和银圈左右摇摆不定 |
| B.保持平衡状态不变 |
| C.铁圈向下倾斜 |
| D.银圈向下倾斜 |
(2)产生上述现象的原因是_________。
(10分)某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸 ②Na+水 ③Al+NaOH溶液。为点燃上述三个反应生成的H2,他们设计了如下装置(图1),请回答下列问题:
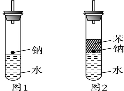
(1)写出Na与H2O反应的化学方程式_____________________________________。
(2)在点燃H2前必须先进行_____________________________________________,
方法是 _______________________________________________________。
(3)实验小组在点燃用图1装置制得的H2时,①③实验获得成功,②却失败了。他们分析认为失败的原因是Na与H2O的反应速率太快,Na的用量太少。于是他们准备增加钠的用量,可老师说太危险,你认为产生危险的原因是________________________________________________________________________。
(4)实验小组查阅钠、苯、水的密度分别为0.97 g·mL-1、0.88 g·mL-1、1.00 g·mL-1,并据此对实验进行了改进(如图2),在改进后的实验中H2的生成速率减慢。原因是________________________________________________________________________。
(11分)铜及其化合物一般都具有特征颜色,例如Cu、Cu2O呈红色,CuO呈黑色、CuSO4·5H2O呈蓝色等。研究性学习小组甲为检测实验室用H2还原CuO所得的红色固体中是否含有 Cu2O进行了认真探究。
Ⅰ.查阅资料:Cu2O属于碱性氧化物;高温灼烧CuO生成Cu2O;Cu2O在酸性条件下能发生下列反应:
Cu2O+2H+===Cu+Cu2++H2O
Ⅱ.设计实验方案:
方案1:取该红色试样溶于足量的稀硝酸中,观察溶液颜色的变化。
方案2:取该红色试样溶于足量的稀硫酸中,观察溶液是否呈蓝色。
方案3:称得干燥坩埚的质量为a g,取红色试样置于坩埚中称得总质量为b g,在空气中高温灼烧至质量恒定,称得最后总质量为c g。
(1)请你评价方案1和方案2。如果你认为该方案合理,请简述其化学原理;如果你认为该方案不合理,请简述原因。
方案1:____________________________________________________________。
方案2:__________________________________________________________。
(2)方案3中,若确认红色粉末中含有Cu2O,则a、b、c应符合的数学的关系为________,该实验方案最少得进行________次称量。
Ⅲ.研究性学习小组乙,设计了新的探究方案,拟通过干燥管中CuSO4是否变蓝判断红色固体中是否含有Cu2O,装置如图所示:
(3)简述该探究方案中,检验气体发生装置气密性的方法(说明操作方法、现象和结论)
________________________________________________________________________。
(4)为确保探究的科学、合理、安全,你认为实验中还应采取的措施有________(填序号)。
A.在氢气发生器与硬质玻璃管之间加一干燥装置
B.加热前先排尽装置中的空气
C.在盛有硫酸铜的干燥管后再连接一个装有碱石灰的干燥管
(9分)氧化铜是一种黑色固体,可溶于稀硫酸。某同学想知道是稀硫酸的哪种粒子(H2O、H+、SO)能使氧化铜溶解。请你和他一起通过如图所示的Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动。
(1)某同学提出的假设是____________________________________________________。
(2)通过实验Ⅰ可以证明___________________________________________________。
(3)要证明另外两种粒子能否溶解氧化铜,还需要进行实验Ⅱ和Ⅲ,在Ⅱ中加入稀硫酸后氧化铜溶解,则进一步确认的实验操作是:在Ⅲ中先加入________,再加入________。
(4)探究结果为______________________。你认为除实验Ⅱ和Ⅲ所用的试剂外,还能溶解氧化铜的一种常见物质是________。
为检验浓硫酸与木炭在加热条件下反应产生SO2和CO2气体,设计了如图所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉。
请回答下列问题:
(1)实验前欲检查装置A的气密性,可以采取的操作是 ;
(2)此实验成败的关键在于控制反应产生气体的速率不能过快,由此设计了虚框部分的装置,则正确的操作顺序是 (用操作编号填写);
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(3)实验时,装置C中的现象为_____________;
(4)当D中产生__________(多选不得分)现象时,可以说明使E中澄清石灰水变浑的是CO2,而不是SO2;
A.进气口一端脱脂棉蓝色变浅,出气口一端脱脂棉蓝色不变
B.脱脂棉上蓝色均变浅
C.脱脂棉上蓝色褪去
则装置D的作用为 。