某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有;
(2)硫酸铜溶液可以加快氢气生成速率的原因是;
(3)实验室中现有、
、
、
等4种溶液,可与实验中
溶液起相似作用的是;
(4)要加快上述实验中气体产生的速率,还可采取的措施有(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 |
||||||
| 4 |
30 |
|||||
| 饱和 |
0 |
0.5 |
2.5 |
5 |
20 |
|
| 10 |
0 |
①请完成此实验设计,其中:1=,
6=,
9=;
②反应一段时间后,实验中的金属呈色,实验E中的金属呈色;
③该同学最后得出的结论为:当加入少量溶液时,生成氢气的速率会大大提高。但当加入的
溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因。
海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
请填写下列空白:
1、步骤⑤的方法是 用到的主要仪器是:
2、检验碘的存在可以用 试剂,现象是 。
碘的用途有 。
实验室要配制100 mL 2 mol/L NaCl溶液,请回答下列问题:
⑴.配制过程中需要使用的主要玻璃仪器包括烧杯、玻璃棒、胶头滴管、量筒和___________。
⑵.用托盘天平称取氯化钠固体,其质量为__________ g。
⑶.下列主要操作步骤的正确顺序是___________(填序号)。
①称取一定质量的氯化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶颈刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③将溶液转移到容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
⑷.如果实验过程中缺少步骤⑤,会造成所配溶液的物质的量浓度_______(填“偏高”或“偏低”或“无影响”,下同);若定容时俯视容量瓶刻度线,会造成所配溶液的物质的量浓度_________。
中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题: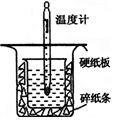
(1)从上图实验装置看,其中尚缺少的一种玻璃用品是__________,除此之外,装置中的一个明显错误是 。
(2)为保证该实验成功该同学采取了许多措施,如图的碎纸条的作用在于___________。
(3)若改用60mL 0.25mol·L-1 H2SO4和50mL 0.55mol·L-1 NaOH溶液进
行反应与上述实验相比,所放出的热量 (填“相等”“不相等”),若实验操作均正确,则所求中和热 填“相等”“不相等”)
(4)倒入NaOH溶液的正确操作是:________。 (从下列选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(5)使硫酸与NaOH溶液混合均匀的正确操作是:________。 (从下列选出)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(6)实验数据如下表:
①请填写下表中的空白:
| 温度 实验次数 |
起始温度t1℃ |
终止温度t2/℃ |
温度差平均值 (t2-t1)/℃ |
||
| H2SO4 |
NaOH |
平均值 |
|||
| 1 |
26.2 |
26.0 |
26.1 |
29.5 |
|
| 2 |
27.0 |
27.4 |
27.2 |
32.3 |
|
| 3 |
25.9 |
25.9 |
25.9 |
29.2 |
|
| 4 |
26.4 |
26.2 |
26.3 |
29.8 |
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=__________ ( 取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)________。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
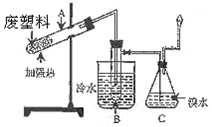
某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图。加热某废塑料得到的产物如下表:
| 产物 |
氢气 |
甲烷 |
乙烯 |
丙烯 |
苯 |
甲苯 |
碳 |
| 质量分数(%) |
12 |
24 |
12 |
16 |
20 |
10 |
6 |
( 1)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔。
1)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔。
A中残留物¾① ®电石¾②®乙炔¾③®聚乙炔
写出反应②的化学方程式 。
(2)试管B收集到的两种产品中,有一种能使酸性高锰酸钾溶液褪色的物质,其一氯代物有_____________种。
(3)锥形瓶C中观察到的现象 。经溴水充分吸收,剩余气 体经干燥后的平均相对分子质量为__________________。
体经干燥后的平均相对分子质量为__________________。
(4)写出C中逸出的气体在工业上的两种用途__________________、__________________。
(5)该废塑料的成分可能是_________。
A.聚氯乙烯 B.聚丙烯 C.聚苯乙烯 D.聚甲基丙烯酸甲酯
醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷的装置如下图所示,试管d中装有少量蒸馏水.已知溴乙烷的沸点为38.4oC,密度为1.43g·ml-1;
可能存在的副反应有:加热反应过程中反应混合物会呈现黄色甚至红棕色;醇在浓硫酸的存在下脱水生成烯和醚等。
(1)制备溴乙烷的需要用到蒸馏水、乙醇、溴化钠、浓硫酸,在烧瓶中加入这几种物质的顺序是 。
(2)小火加热,在烧瓶中发生的主要反应有①NaBr + H2SO4= NaHSO4 + HBr
② .;
(3)冷水的作用 ;d试管中的现象 ,
(4)用这种方法制取的溴乙烷中的含少量杂质Br2,欲除去溴代烷中的少量杂质Br2,下列供选试剂中最适合的是__________。
A.NaI溶液 B.NaOH溶液 C.Na2SO3溶液 D.KCl溶液
(5)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞.请写出发生堵塞时瓶b中的现象________________
(6)容器e中NaOH溶液的作用是__________________________________.
(7)制备操作中,加入的浓硫酸必需进行适当的稀释,其目的是_______。
A.减少副产物烯和醚的生成 B.减少Br2的生成
C.减少HBr的挥发 D.水是反应的催化剂 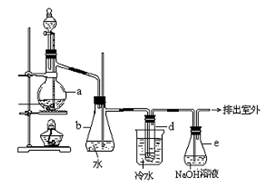
(12分,本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分)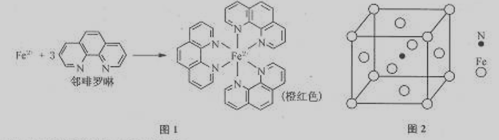
(1)Fe2+在基态时,核外电子排布式为 。
(2)羟胺(NH2OH)中采用sp3杂化的原子有 ,羟胺熔沸点较高,是因为分子间存在较强的 。
(3)Fe2+与邻啡罗啉形成的配合物(形成过程如图1)中,配位数为 。
(4)根据价层互诉理论,C1O4—空间构形为 。
(5)铁能与氮形成一种磁性材料,其晶胞结构如图2,则该磁性材料的化学式为 。
B.生物柴油是高级脂肪酸甲酯,可由油脂与甲醇通过取代反应(酯交换,生成新酯和新醇)得到,用菜籽油制备生物柴油的步骤如下:
①将三口烧瓶和锥形瓶做干燥处理,先向三口烧瓶中加入20g菜籽油,再称取40g正已烷(约61mL)。
②称取甲醇4.6g(约5.8mL)放到锥形瓶中,然后称取0.2g氢氧化钠固体并使之溶解,然后加到三口烧瓶中。
③如下图所示安装三口烧瓶。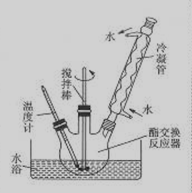
④恒温水浴加热,使温度保持在60—65℃左右,搅拌1.5—2h。
⑤停止加热后,冷却,取出三口烧瓶,静置、分液,上层
为生物紫油,正已烷和甲醇,下层主要为甘油。
⑥用温水洗涤制得的生物柴油3—4次。
⑦将水洗后的溶液倒入圆底烧瓶中,蒸馏,温度保持在
120℃左右,直至无液体蒸出后,烧瓶中剩余的液体主要即为
生物柴油。
(1)氢氧化钠的作用是 。
(2)正已烷的作用是 。
(3)图中冷凝管的作用是 。
(4)步骤⑤分液,用到的主要的一种玻璃仪器是 (写名称)
(5)确定步骤⑥已洗涤干净的方法是 。
(6)酸价(1g油酯的游离脂肪酸所需氢氧化钾的毫克数)的测定
a. 称取均匀试样Wg注入锥形瓶中,加入石油醚—乙醇混合液25mL,摇动锥形瓶使试样溶解。
b.滴入3滴酚酞,用0.100 mol/L KOH溶液滴定至出现微红色且保持30s不消失,消耗KOH溶液VmL。
则该生物柴油的酸价为 (用含W、V的代数式表示)
氯酸钾是无机盐工业的重要产品之一,可通过反应:NaC1O3+KC1 KC1O3↓+NaC1制取。
(1)实验室制取氯酸钠可通过反应:3C12+6NaOH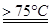 5NaC1+NaC1O3+3H2O,今在—5℃的NaOH溶液中通入适量C12(平衡常数K=1.09×1012),此时C12的氧化产物主要是 ;将溶液加热,溶液中主要离子浓度随温度的变化如右图所示,图中A、B、C依次表示的离子是 。
5NaC1+NaC1O3+3H2O,今在—5℃的NaOH溶液中通入适量C12(平衡常数K=1.09×1012),此时C12的氧化产物主要是 ;将溶液加热,溶液中主要离子浓度随温度的变化如右图所示,图中A、B、C依次表示的离子是 。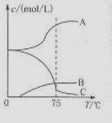
(2)工业上制取氯酸钠采用在热的石灰乳通入氯气,然
后结晶除去氯化钙后,再加入一种钠盐,合适的钠盐是
。
(3)北美、欧洲国家生产氯酸钠用二级精制盐水。采用
无隔膜电解法获得,生产过程中涉及的主要的化学反应式如下:
总反应式:NaC1+3H2O NaC1O3+3H2↑
NaC1O3+3H2↑
阳极:2C1——2e— C12↑阴极:2H2O+2e— H2↑+2OH—
液相反应:C12+H2O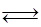 HC1O+H++C1— HC1O
HC1O+H++C1— HC1O H++C1O—
H++C1O—
2HC1O+CO— C1O3—+2C1—+2H+
精制食盐水时,要除去其中的Ca2+、Mg2+及SO42—并得到中性溶液,依次加入的化学试剂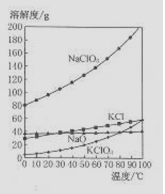
是 、 、 ;过滤,滤液中再加入适量的稀盐酸,得一级精制盐水再经离子交换处理或膜处理得到二级精制盐水。
②电解时,必须在食盐水中加入Na2Cr2O7,其目的是防止 (填离子符号)电解过程中在阴极上放电。
(4)若NaC1O3与KC1的混合溶液中NaC1O3与KC1的质量分数分别为0.290和0.203(相关物质的溶解度曲线如右图)。从混合溶液中获得较多KC1O3晶体的实验操作依次
为 (填操作名称)、干燥。
(5)样品中C1O3—的含量可用滴定法进行测定,实验步骤
如下:
步骤1:准确称取样品ag(约2.20g),经溶解、定容等步骤准确配制1000mL溶液。
步骤2:从上述容量瓶中取出10.00mL于锥形瓶中,准确加入25mL1000mol/L(NH4)2Fe(SO4)2。溶液(过量),加入75mL硫酸和磷酸配成的混酸,静置10min。
步骤3:再在锥形瓶中加入100mL蒸馏水及某种氧化还原反应指示剂,用0.200mol/LK2Cr2O7标准溶液滴定至终点。
步骤4: 。
步骤5:数据处理与计算。
①步骤2,静置10min的目的是 。
②步骤3中K2Cr2O2标准溶液应盛放在 中(填仪器名称)。
③为了确定样品中C1O3—的质量分数,步骤4的操作内容是 。
用质量分数为98%的浓硫酸(密度为1.84g/cm3)配制成1mol/L的稀硫酸.现实验室仅需要这种硫酸220mL.试回答下列问题:
(1)配制稀硫酸时,应选用容量为________mL的容量瓶;
(2)经计算需要用量筒量取________mL浓硫酸,在量取时宜选用下列量筒中的____(填字母).
| A.5mL | B.10mL | C.15mL | D.50mL |
(3)在量取浓硫酸后,进行了下列操作:
①等稀释的硫酸其温度与室温一致后,沿玻璃棒注入容量瓶中。
②往容量瓶中小心加蒸馏水至液面接近环形标线1-2cm处,改用胶头滴管加蒸馏水,使溶液的凹液面底部与瓶颈的环形标线相切。
③在盛硫酸的烧杯中注入蒸馏水少量,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶上述操作中,正确的顺序是(填序号)________。
(4)指出本实验操作错误的地方,并进行更正______________________________________
(5)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓硫酸,其配制的稀硫酸浓度会________(填“偏高”、“偏低”、“无影响”,下同).若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则配制的稀硫酸浓度会________。
1)有右下图所示A、B、C、三种仪器:
请写出三种仪器的名称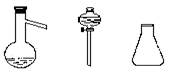
A B C
A______________B______________C_____________
(2)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图.由图中可以看出,该同学在操作时的一个错误是________,烧杯的实际质量______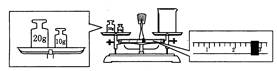 g。
g。
(3)指出下面3个实验中各存在的一个错误: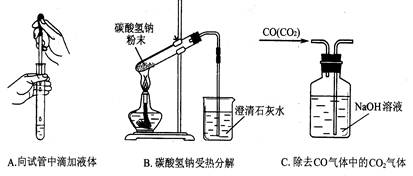
A__________________________,
B__________________________,
C__________________________。
(4)Fe(OH)3胶体制备的操作是
________________________________________________________
(12分)实验室有一瓶密封不严的漂白粉,请利用以下仪器和试剂,完成该漂白粉成分的探究。试管、滴管、带导管的单孔塞、蒸馏水、自来水、1mol/LHCl、品红溶液、新制澄清石灰水。
(1) 提出假设:假设一:该漂白粉未变质,含________________________。
假设二:该漂白粉全部变质,含________________________。
假设三:该漂白粉部分变质,含CaCl2 , Ca(ClO)2 ,CaCO3
(2)进行实验:在答题卡上完成下表(不必检验Ca2+、Cl-)
| |
实验步骤 |
预期现象和结论 |
| ① |
用A试管取少量澄清石灰水备用,用B试管取少量样品,再向B试管加入__________ |
若无气体放出且澄清石灰水未见浑浊,则假设________成立: |
| ② |
|
|
| ③ |
|
|
(20分)A、B、C、D、E、F、G、H、I、J均为有机化合物。根据以下框图,回答问题: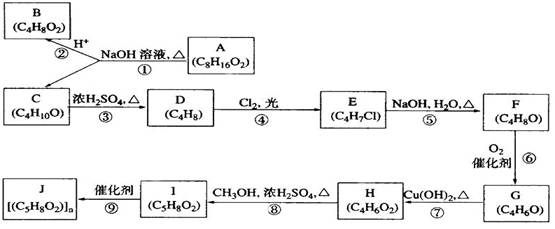 ( l ) B和C均为有支链的有机化合物,B 的结构简式______________________;C在浓硫酸作用下加热反应只能生成一种烯烃D , D的结构简式为:__________________;I的结构简式:______________________。
( l ) B和C均为有支链的有机化合物,B 的结构简式______________________;C在浓硫酸作用下加热反应只能生成一种烯烃D , D的结构简式为:__________________;I的结构简式:______________________。
(2)G能发生银镜反应,也能使溴的四氯化碳溶液褪色,则G的结构简式为____;
(3)⑤的化学方程式是_____________________________________________;
⑨的化学方程式是______________________________________________;
(4)③的反应类型是______,④的反应类型是_____,⑦的反应类型是________;
(5)与H具有相同官能团的H的同分异构体的结构简式为______________。
(共13分)(1)右图甲中装置甲是某种不溶于水的气体X的发生装置和收集装置(必要时可以加热),所用的试剂从下列试剂中选取2-3种:硫化亚铁、二氧化锰、铜屑、氯化铵、稀氨水、大理石、浓硫酸、浓硝酸、稀硝酸、蒸馏水。
回答下列问题:
①气体X的分子式是 。
②所选择的药品a是 ,b是 , c是 。
③下列装置乙和丙,能代替装置甲的简易装置是 (填“乙”或“丙”)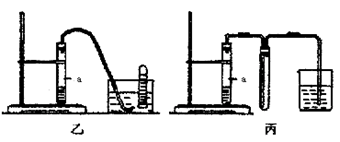
④请写出在试管a中所发生反应的化学方程式 。
⑤从反应开始到反应结束,预期在试管a中可观察到的气体的实验现象有哪些,请依次逐步写出 ; ;
(2)在进行研究性学习的过程中,学生发现等质量的铜片分别与等质量均过量的浓硝酸或稀硝酸反应,所得到溶液前者呈绿色,后者呈蓝色,针对这种现象,学生进行了讨论,出现两种意见,一种认为:Cu2+浓度差异引起了这种现象,你认为 (填“正确”或“不正确”),依据是: ;
另一种意见是:溶液呈绿色可能是Cu2+与NO2混合的结果,并用实验进行了证明,请简述实验方案与实验现象: 。