磁性氧化铁(Fe3O4)可用于制造录音磁带和电讯器材,其溶于稀硝酸的化学方程式为:
3Fe3O4+28HNO3(稀)=9Fe(NO3)3+NO↑+14H2O。
(1)Fe3O4晶体的颜色为______________。
(2)Fe(NO3)2在水溶液中的电离方程式为________________________。
(3)上述反应中,氧化剂是_____________(填化学式),被还原的氮元素与未被还原的氮元素的物质的量之比为_________,每生成2.24L(标准状况下)NO时,转移电子的物质的量为____________mol。
工业上用铝土矿(主要成分为Al2O3,还有少量的Fe2O3,SiO2等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如下:
(1)Ⅰ和Ⅱ步骤中分离溶液和沉淀的操作是:_____________。
(2)沉淀M中除含有泥沙外,一定还含有_________(填化学式),生成固体N反应的化学方程式为_________。
(3)滤液X中,含铝元素的溶质的化学式为___________,它属于__________(填“酸”、“碱”或“盐”)类物质。
(4)实验室里常往AlCl3溶液中加入___________(填“氨水”或“NaOH溶液”)来制取Al(OH)3,该反应的离子方程式为__________________________。
(5)滤液Y中除了含有Na2CO3或NaHCO3外,一定还含有__________________。
烟气中主要污染物为SO2、NO、NO2,可用如下工艺进行脱硫脱硝及产物回收。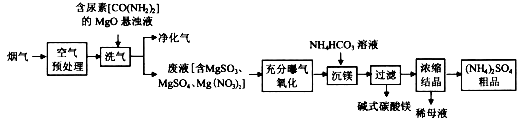
(1)空气预处理过程中,发生主要反应的化学方程式为____________________________。
(2)洗气过程中,尿素作还原剂,转化成两种无污染的气体是_________________(填化学式)。
(3)充分曝气氧化过程中,发生反应的化学方程式为___________________。
(4)完成沉镁过程中生成碱式碳酸镁[MgCO3∙Mg(OH)2]的离子方程式
______Mg2++______= MgCO3∙Mg(OH)2↓+______CO2↑+______H2O
(5)(NH4)2SO4粗品中含有的主要杂质为__________(填名称)。
(6)碱式碳酸镁经过简单加工可循环利用,加工过程发生反应的化学方程式为________________。
某学习小组共同学习乙醛的化学性质,以下是他们的学习过程,请填空:
(1)根据乙醛的结构对性质进行预测
| 乙醛的结构特点 |
可能的化学性质 |
有 双键,不饱和 双键,不饱和 |
与H2发生 反应,乙醛表现 性 |
 CHO中C-H键极性较强 CHO中C-H键极性较强 |
 CHO中C—H键被氧化,变为C—OH CHO中C—H键被氧化,变为C—OH |
(2)写出乙醛与氢气反应的方程式
(3)设计实验验证乙醛的还原性,请填全表格。
| 实验 |
现象 |
结论 |
| 取适量乙醛溶液,滴加高锰酸钾酸性溶液 |
|
乙醛能被高锰酸钾氧化 |
| 向新制银氨溶液中加入几滴乙醛溶液,水浴加热 |
试管壁上出现 |
乙醛将银氨溶液还原 |
| 向新制氢氧化铜悬浊液中加入适量乙醛溶液,加热 |
|
乙醛被氢氧化铜氧化 |
根据上表及所学知识回答:
①乙醛被高锰酸钾溶液氧化为 (填结构简式)
②写出乙醛发生银镜反应的方程式
(4)某有机物只含C、H、O三种元素,该有机物对氢气的相对密度为15,完全燃烧 0.1mol该有机物生成4.4gCO2和1.8gH2O,该有机物的分子式为 ,若红外光谱显示该分子中有醛基,则3g该物质与足量的新制氢氧化铜反应,生成沉淀的质量为 g
(1)根据官能团对下列有机物进行分类,将它们的类别填写在横线上。
(2)在①HC≡CH②C2H5Cl,③CH3CH2OH,④CH3COOH,⑤聚乙烯,⑥ 六种物质中:
六种物质中:
①能与溴水发生化学反应是________;②属于高分子化合物的是________;
③能与Na2CO3溶液反应的是________;④能发生酯化反应的是________;
⑤能发生消去反应的是。
(3)下图中A、B、C分别是三种有机物分子的表示方法:
请回答下列问题:
①A、B两种模型分别是有机物的________模型和________模型。
②A、B、C三种有机物中,所有原子均共面的是________(填字母序号)。
③有机物C具有的结构或性质是________(填字母序号)。
a.是碳碳双键和碳碳单键交替的结构
b.有特殊气味、有毒、易溶于水、密度比水大
c.一定条件下能与液溴发生取代反应
d.能与浓硝酸发生氧化反应
生活中为了延长鲜花的寿命,通常会在花瓶中加入鲜花保鲜剂。下表是0.5 L某种鲜花保鲜剂中含有的成分及含量,阅读后回答下列问题:
| 成分 |
质量(g) |
摩尔质量(g/mol) |
| 蔗糖(C12H22O11) |
25.00 |
342 |
| 硫酸钾(K2SO4) |
0.25 |
174 |
| 高锰酸钾(KMnO4) |
0.25 |
158 |
| 阿司匹林(C9H8O4) |
0.17 |
180 |
| 硝酸银(AgNO3) |
0.02 |
170 |
(1)鲜花保鲜剂的下列成分中,属于电解质的是___________(填序号)。
a.蔗糖 b.硫酸钾 c.硝酸银
(2)欲配制500 mL该鲜花保鲜剂,现已提供下列仪器:①胶头滴管、②量筒、③烧杯、④ 药匙、⑤玻璃棒、⑥天平,如要完成实验,缺少的玻璃仪器还有_______________(写仪器名称)。
(3)写出该鲜花保鲜剂中K+的物质的量浓度的计算式:___________________ mol/L(可以不化简)。
下图是某儿童微量元素体检报告单的部分数据:

根据上表的数据,回答下列问题:
(1)该儿童 元素含量偏低。
(2)报告单中“μmol/L”是 (填“质量”、“体积”或“浓度”)的单位。
(3)服用维生素C可使食物中的Fe3+转化为Fe2+。在这个过程中体现维生素C的 (填“氧化性”或“还原性”)。
(4)缺铁性贫血患者应补充Fe2+。一些补铁剂以硫酸亚铁为主要成分,用硫酸亚铁制成药片时外表包有一层特殊的糖衣,推测糖衣的作用是 。
有四种物质:①Al2O3、②HNO3、③NaHCO3、④Ba(OH)2。根据要求,回答下列问题:
(1)写出物质④的电离方程式_______________________________。
(2)写出物质②和③反应的离子方程式_______________________________。
(3)既能与强酸反应,又能与强碱反应的物质是____________(填序号)。
填空
(1)、甲溶液的pH是2,乙溶液的pH是4,求甲溶液和乙溶液的c(H+)之比为 。
(2)、电解饱和食盐水时,阴极析出气体是 (填化学式)。
(3)、现有学生做如下实验:将盛有滴加酚酞的0.1 mol/L NaHCO3溶液的试管微热时,观察到该溶液的浅红色加深;若冷却至室温时又变回原来的浅红色,发生该现象的主要原因是 。(结合离子反应方程式说明)
(4)、已知25℃时,醋酸和亚硫酸的电离平衡常数:醋酸K=1.75×10-5 ,亚硫酸K1=1.54×10-2、
K2=1.02×10-7。则25℃时,相同浓度醋酸和亚硫酸溶液的酸性强弱:CH3COOH H2SO3(填>、<或=)。
(5)、向明矾溶液中逐滴加入Ba(OH)2溶液,若加至铝离子刚好完全沉淀,请写出反应的离子反应方程式: 。
(6)、炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请写出铁锅腐蚀正极的电极反应式: 。
某化学兴趣小组对以下三种品牌牙膏中摩擦剂成分进行调查,结果如下表:
| 牙膏品牌 |
两面针儿童牙膏 |
珍珠防臭牙膏 |
中华透明牙膏 |
| 摩擦剂 |
氢氧化铝 |
碳酸钙 |
二氧化硅 |
针对三种磨擦剂回答下列问题:
(1)属于酸性氧化物的是 (填化学式,下同),既能与强酸反应又能与强碱反应的是 。
(2)氢氧化铝与强碱溶液反应的离子方程式是 。
(3)工业上常用碳还原SiO2来制备晶体硅,其反应方程式是 。
NO、NO2、NH3、SO2、CO等都是空气污染物。
(1)酸雨的形成主要是大气中的_________溶于水后形成了酸性溶液。
(2)在汽车的排气管上装一个催化转化装置,可使汽车尾气中的NO与CO反应,生成氮气和碳的另一种无污染的气体,请完成该转化的化学方程式: NO + CO—N2+ 。
金属钠在空气中充分燃烧生成的产物呈 色,将所得产物投入水中,产物和水迅速发生反应。写出产物与水反应的化学方程式: 。
标准状况下4.48 L HCl的质量是__________g,将其溶于水配成100mL的溶液,所得溶液的物质的量浓度为 mol/L。
今有七种物质:①铝片 ②KNO3 ③氯气 ④NaCl晶体 ⑤液态氯化氢 ⑥石灰水 ⑦乙醇,属于电解质的是 ,属于非电解质的是 。
数十年来,化学工作者对碳的氧化物和氢化物做了广泛深入的研究并取得了一些重要成果。已知:C(s)+O2(g)=CO2(g);ΔH=-393 kJ·mol-1
2CO (g)+O2(g)=2CO2(g);ΔH=-566 kJ·mol-1
2H2(g)+O2(g)=2H2O(g);ΔH=-484 kJ·mol-1
(1)工业上常采用将水蒸气喷到灼热的炭层上实现煤的气化(制得CO、H2),该反应的热化学方程式是 。
(2)上述煤气化过程中需向炭层交替喷入空气和水蒸气,喷入空气的目的是 ;该气化气可在加热和催化剂下合成液体燃料甲醇,该反应方程式为 。
(3)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH3OH(g) === HCOOCH3(g)+2H2(g) △H>0
第二步:HCOOCH3(g) === CH3OH(g) +CO(g) △H>0
则以甲醇制一氧化碳的反应为 反应(填“吸热”、“放热”)。
(4)科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以
CO2和H2O合成CH4。

①写出铜电极表面的电极反应式 。
②为提高该人工光合系统的工作效率,可向装置中加入少量 (选填“氢氧化钠”或“硫酸”)。
(5)天然气也可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃X。由质谱分析得X的相对分子质量为106,其核磁共振氢谱如图,则X的结构简式为 。
