将2.5 g Na2CO3、NaHCO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1 mol/L的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:
(1)写出OA段所发生反应的离子方程式___________________。
(2)当加入35 mL盐酸时,产生CO2的体积为________mL(标准状况)。
(3)计算原混合物中NaOH及碳酸钠的质量。
将一定质量的镁铝合金投入100 mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5 mol/L NaOH溶液至过量,生成沉淀的质量与加入氢氧化钠溶液的体积的关系如图所示。请回答以下问题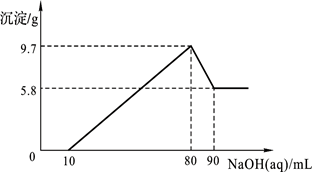
(1)当沉淀达到最大值时,求Al(OH)3的质量;
(2)原合金中Mg的质量;
(3)盐酸的物质的量浓度。
(12分)小苏打、胃舒平、达喜都是常用的中和胃酸的药物。
(1)小苏打片每片含0.42 gNaHCO3,2片小苏打片和胃酸完全中和,被中和的氢离子是
_______mol。
(2)胃舒平每片含0.135 g Al(OH)3。中和胃酸时,6片小苏打片相当于胃舒平片。
(3)达喜的化学成分是铝和镁的碱式碳酸盐。
①取该碱式碳酸盐2.20g,加入2.0 mol·L-1盐酸使其溶解,当加入盐酸30 mL时开始产生CO2,加入盐酸至35 mL时正好反应完全,计算该碱式盐样品中氢氧根与碳酸根的物质的量之比_________。
②在上述碱式盐溶于盐酸后的溶液中加入过量氢氧化钠,过滤,沉淀物进行干燥后重1.16g,试推测该碱式盐的化学式_________。
钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。
完成下列计算:
(1)叠氮化钠(NaN3)受撞击分解产生钠和氮气,故可应用于汽车安全气囊。若78克叠氮化钠完全分解,产生标准状况下氮气___________________L 。
(2)钠-钾合金可在核反应堆中用作热交换液。5.05 g钠-钾合金溶于200 mL水生成0.075 mol氢气。计算溶液中氢氧化钠的物质的量浓度______________________(忽略液体体积变化)。
(3)氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液。向该溶液中通入二氧化碳,有下列反应: 2NaAl(OH)4+CO2→2Al(OH)3↓+Na2CO3+H2O。己知通入二氧化碳112 L(标准状况下),生成的Al(OH)3和Na2CO3的物质的量之比为4:5。若向该溶液中通入的二氧化碳为224L(标准状况下),计算生成的 Al(OH)3和Na2CO3的物质的量的最大值。
(4)为测定某硫酸吸收含氨气废气后,所得铵盐中氮元素的质量分数,现将不同质量的铵盐固体分别加入到50.00mL相同浓度的氢氧化钠溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。部分测定结果如下表:
| 铵盐的质量/g |
10.00 |
20.00 |
30.00 |
50.00 |
| 浓硫酸增加的质量/g |
m |
m |
1.29 |
0 |
试回答:
该铵盐的成分为_______________________________。
该铵盐中氮元素的质量分数为:_______________________________(须列式计算)。
25 ml 加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置。待完全反应后,用0.1 mol/L的Na2S2O3溶液作标准溶液滴定反应生成的碘,已知反应式为:
2Na2S2O3 + I2 = Na2S4O6 + 2NaI
反应完成时,共用去Na2S2O3 20.0 ml。则该漂白粉中Ca(ClO)2的质量分数为:
14、向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
完成下列填空:
1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
2)整个过程中的还原剂是。
3)把KI换成KBr,则CCl4层变为__色:继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是。
4)加碘盐中含碘量为20mg~50mg/kg。制取加碘盐(含KIO3的食盐)1000kg,若用Kl与Cl2反应制KIO3,至少需要消耗Cl2L(标准状况,保留2位小数)。
某结晶水合物A含有两种阳离子和一种阴离子。将溶有90.60gA的水溶液分成两等份,向第一份逐滴加入NaOH溶液,溶液先出现白色沉淀后完全溶解,此过程中产生2.24 L(标准状况)刺激性气味的气体。向第二份加入过量的Ba(OH)2溶液,过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.60 g。
请回答以下问题:
(1)试通过计算确定该结晶水合物的化学式为;
(2)若第二份加入75.00 mL2.00 mol·L-1的Ba(OH)2溶液,则得到的沉淀质量为。
物质结构理论有助于人们理解物质变化的本质,进行分子设计和研究反应规律。请回答下列问题:
(1)第三周期基态原子有2个未成对电子且电负性最大的元素是_____;
(2)金属晶体受到外力作用时易发生形变,而离子晶体容易破裂。试从结构的角度分析其中的主要原因____________;
(3)已知在水中存在平衡2H2O=H3O++OH-。下列分子中,中心原子采取的杂化方式与H3O+中氧原子的杂化方式相同的是_____
a.CH2=CH2中的碳原子 b.NH2-中的氮原子
c.ClO3-中的氯原子 d.NO2-中的氮原子
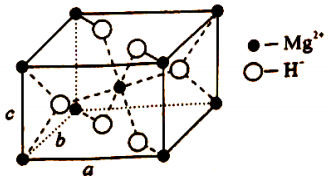
(4)F、Mg、K三种元素形成的晶体晶胞结构如图所示,一个晶胞中Mg元素的质量分数为________。
氢气的生产、存储是氢能应用的核心。目前较成熟的生产、存储路线之一为:利用CH 3OH和H 2O在某Cu/Zn﹣Al催化剂存在下生产H 2,H 2与Mg在一定条件下制得储氢物质X。
回答问题:
(1)Al在周期表中的位置 。基态Zn的价层电子排布式 。
(2)水分子中氧原子的杂化轨道类型 。
(3)键能是衡量共价键稳定性的参数之一。 CH 3OH键参数中有 种键能数据。CH 3OH可以与水以任意比例互溶的原因是 。
(4)X的晶胞结构如图所示(晶胞参数:α=β=γ=90°,a=b=450.25pm),密度为1.4g•cm ﹣ 3,H ﹣的配位数为 ,X的储氢质量分数是 ,c= pm (列出计算式即可)。
将6g的铁粉加入200mL Fe2(SO4)3和CuSO4的混合溶液,充分反应得到200mL 0.5mol/LFeSO4溶液和5.2g固体沉淀物。试计算
(1)反应后生成铜的质量;
(2)原Fe2(SO4)3溶液的物质的量浓度。
某厂每天产生800m3含氮的废水(NH3的含量为168mg∙L-1)。该厂处理废水的方法是:将废水加热得到NH3,使废水中NH3的含量降为15mg∙L-1(假设废水处理前后体积不变)。再对加热蒸发得到的NH3进一步处理制取硝酸。
(1)制取硝酸过程中主要发生反应如下:①_________________,②4NO+3O2+2H2O=4HNO3。反应①是氨气在一定条件下被氧气氧化,请在横线上写出该反应的化学方程式。
(2)该厂每天通过加热蒸发可得到NH3的物质的量是__________________。
(3)若在反应①中N元素损失10%,则该厂每天可生产硝酸多少吨?(写出计算过程,结果保留2位小数)
氢气是化工行业重要原料之一。
(1)电解饱和食盐水是生产H2的方法之一。常温下,电解250 mL饱和食盐水一段时间后,溶液质量减轻0.365 g(假设气体全部逸出)。生成的氢气在标准状况下的体积为 mL。
(2)在电弧炉中,甲烷裂解产生乙炔和氢气,若1 m3 甲烷经此过程生成0.27 m3氢气,则甲烷的裂解率为 %(体积均在相同条件下测定)。
(3)已知:CxHy + H2O → CO + CO2 + H2(未配平)。工业上用甲烷、乙烷的混合气体利用上述反应生产氢气,反应后气体经干燥组成如下表所示:
| 组分 |
CO |
CO2 |
H2 |
| 体积分数 |
20% |
5% |
75% |
计算原混合气体中甲烷与乙烷的物质的量之比。
(4)合成氨生产过程中,消耗氮氢混合气2000 m3(其中CH4的体积分数为0.112%,下同),分离液氨后的氮氢混合气中含CH4 2.8%。计算分离出液氨为多少吨(保留2位小数,所有体积均已折算至标准状况)。
碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·xH2O]常用作塑料阻燃剂。
(1)碱式碳酸铝镁具有阻燃作用,是由于其受热分解需吸收大量热量和 。
(2)MgaAlb(OH)c(CO3)d·xH2O中a、b、c、d的代数关系式为 。
(3)为确定碱式碳酸铝镁的组成,进行如下实验:
①准确称取3.390g样品与足量稀盐酸充分反应,生成CO20.560L(已换算成标准状况下)。②另取一定量样品在空气中加热,样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如右图所示(样品在2700C时已完全失去结晶水,6000C以上残留固体为金属氧化物的混合物)。
根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-): n(CO32-)(写出计算过程)。
通常情况下,CO与O2的混合气体m L,用电火花引燃后体积变为n L(在相同条件下测定)。
(1)试确定原混合气体中CO与O2的体积。
(2)若反应后的气体密度在相同条件下为氢气的15倍时,试确定反应气体的组成及体积之比。
(12分)化学需氧量(COD)常作为衡量水体中有机物含量多少的指标。某化学课外小组的同学拟采用碱性高锰酸钾溶液测定某海水试样的COD,实验流程如下:
已知:①弱碱性条件下MnO4-被还原性物质还原为MnO2
②10I-+2MnO4-+16H+=5I2+2Mn2++8H2O
③2S2O32-+I2=2I-+S4O62-
(1)测定海水试样的COD,采用碱性高锰酸钾溶液而不采用酸性高锰酸钾溶液,其可能原因是。
(2)氧化后的水样煮沸后,需冷却并在暗处再加入KI和硫酸,需在暗处的原因是。用Na2S2O3,标准溶液滴定,终点时溶液颜色的变化是。
(3)滴定到终点时消耗Na2S2O3标准溶液10.00mL。根据以上实验数据计算海水试样的COD(用每升水样相当于消耗多少毫克O2表示,单位:mg•L-1)(写出计算过程)。