聚合硫酸铝铁[AlaFeb(OH)n(SO4)m·xH2O]是一种新型高效净水剂,广泛应用于工业污染水的处理。
(1)聚合硫酸铝铁能够净水的原因是
(2)AlaFeb(OH)m(SO4)n•xH2O中a、b、m、n的代数关系式为_______________________。
(3)为了测定聚合硫酸铝铁的组成,进行如下实验:
步骤一:准确称取8.810g样品溶于150mL 0.100mol•L-1稀硫酸,恰好完全反应后,加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体10.485g;
步骤二:另取相同质量的样品,溶于过量的氢碘酸,以磁力搅拌机搅拌,充分反应后,以0.500mol•L-1Na2S2O3溶液滴定至浅黄色,滴入几滴淀粉溶液,再滴定至终点,消耗Na2S2O3溶液20.00mL.(已知:I2+2Na2S2O3=2NaI+Na2S4O6)
①步骤二中使用磁力搅拌器进行搅拌的目的是________________________。
②通过计算确定聚合硫酸铝铁的化学式(写出计算过程)。
硫酸亚铁可与等物质的量的硫酸铵生成硫酸亚铁铵:(NH4)2SO4·FeSO4·6H2O,商品名称为莫尔盐,是一种复盐。一般亚铁盐在空气中易被氧气氧化,形成复盐后就比较稳定。与其他复盐一样,硫酸亚铁铵在水中的溶解度比组成它的每一种盐的溶解度都小,且几乎不溶于乙醇,利用这一性质可以制取硫酸亚铁铵晶体。三种盐的溶解度(单位为g/l00gH2O)见下表:
实验用品:10% Na2CO3溶液、Fe屑、3mol/LH2SO 4、( NH4)2SO4、蒸馏水、无水乙醇。
4、( NH4)2SO4、蒸馏水、无水乙醇。
实验步骤流程图:
请完成以下实验记录:
(1)步骤I中处理铁屑所用试剂为________________,经处理后的干燥铁屑质量记为m1;
(2)将称量好的Fe屑放入锥形瓶中,加入适量3mol/LH2SO4溶液,放在水浴中加热至气泡量产生较少时为止(有氢气生成,用明火加热注意安全)。趁热过滤,并用少量热水洗涤锥形瓶及滤纸,将滤液和洗涤液一起转移至蒸发皿中。将滤纸上的固体常温干燥后称重,记为m2;
(3)称取一定质量的(NH4)2SO4,加入______ g(用含m1和m2的代数式表示,要求化简,下同。)水配制成室温下( 20℃)的饱和溶液,并将其加入到上面实验的蒸发皿中,缓缓加热,浓缩至表面出现结晶薄膜为止。放置冷却,得到硫酸亚铁铵的晶体,过滤后用________________洗涤晶体。
(4)称量生成的硫酸亚铁铵的质量,理论上为________________g。
如图装置中,容器甲内充入0.1 mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时容器体积缩小至最小,为原体积的 ,随着CO2的继续通入,活塞又逐渐向右移动。(不考虑活塞的磨擦)
,随着CO2的继续通入,活塞又逐渐向右移动。(不考虑活塞的磨擦)
已知: 2Na2O2 + 2CO2 → 2Na2CO3 + O2
(1)已知当活塞移至C处时,干燥管中物质的质量增加了2.24 g。
①此时,通入标准状况下的CO2气体多少L?
②容器甲中NO2转化为N2O4的转化率是多少?
③活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处.则a值必0.01(填大于、小于、等于),其理由是。
(2)若改变干燥管中Na2O2的量,要通过调节甲容器的温度及通入的量CO2,使活塞发生从D到C,又从C到D的移动,则Na2O2的质量最小值应大于________g。
在一定温度下,10L密闭容器中加入5molSO2、4.5molO2,经 10min后反应达平衡时有3molSO2发生了反应。试计算:
10min后反应达平衡时有3molSO2发生了反应。试计算:
1)用SO2表示该反应的反应速率为多少?
2)O2的转化率为多少?
3)平衡常数K为多少?
(10分)某有机物的蒸气密度是相同状况下甲烷密度的3.625倍。把1.16g该有机物在氧气中充分燃烧,将生成的混合物依次通过足量浓硫酸和碱石灰,分别增重1.08g和2.64g,试求该有机物的分子式,要求有一定的答题步骤。
某混合气体由一种气态烷烃和一种气态 烯烃组成,在同温同压下,混合气体对氢气的相对密度为13,在标准状况下,将44.8L混合气体通入足量溴水,溴水质量增重28.0g,通过计算回答:
烯烃组成,在同温同压下,混合气体对氢气的相对密度为13,在标准状况下,将44.8L混合气体通入足量溴水,溴水质量增重28.0g,通过计算回答:
(1)混合气体中气态烷烃的化学式;
(2)混合气体中两种气体的物质的量之比;
(3)写出混合气体中气态烯烃可能的结构简式;
金属及其化合物变化多,用途广。请完成下列计算:
(1)等物质的量的镁在氧气中充分灼烧,产物质量为a g,比它在空气中灼烧所得产物增重b g。它在空气中灼烧后的产物中Mg3N2的质量分数是(用a、b表示,只考虑空气中氮气、氧气参与反应)。
(2)硬铝(因其主要成分,在此仅看作Al-Cu合金)常用于建筑装潢。1.18g某种硬铝恰好与10mL某浓度的硝酸完全反应,生成的混合气体(其中NO2与NO的体积比为2:1)再与448mL氧气(标准状况)混合,恰好能被水完全吸收。
①计算该硝酸的物质的量浓度。
②计算并确定此种硬铝的化学式。
(3)取5.1g Al-Mg合金与200mL 1mol·L-1的NaOH(aq)充分反应,产生气体a L。过滤,向滤液中通入V L CO2后开始出现沉淀,继续通入CO2使沉淀完全。过滤、洗涤、干燥、灼烧,得到固体5.1 g。则a = ,V = 。(气体体积均为标准状况)
(4)向Cu、Cu2O和CuO的混合粉末中加入500mL 0.6 mol·L-1 HNO3(aq),恰好完全溶解,同时收集到1120 mL NO(标准状况)。通过计算推断混合粉末中Cu的物质的量。
氢气的生产、存储是氢能应用的核心。目前较成熟的生产、存储路线之一为:利用CH 3OH和H 2O在某Cu/Zn﹣Al催化剂存在下生产H 2,H 2与Mg在一定条件下制得储氢物质X。
回答问题:
(1)Al在周期表中的位置 。基态Zn的价层电子排布式 。
(2)水分子中氧原子的杂化轨道类型 。
(3)键能是衡量共价键稳定性的参数之一。 CH 3OH键参数中有 种键能数据。CH 3OH可以与水以任意比例互溶的原因是 。
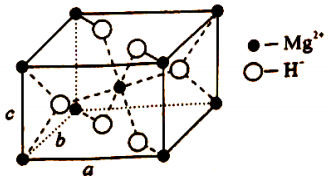
(4)X的晶胞结构如图所示(晶胞参数:α=β=γ=90°,a=b=450.25pm),密度为1.4g•cm ﹣ 3,H ﹣的配位数为 ,X的储氢质量分数是 ,c= pm (列出计算式即可)。
将6g的铁粉加入200mL Fe2(SO4)3和CuSO4的混合溶液,充分反应得到200mL 0.5mol/LFeSO4溶液和5.2g固体沉淀物。试计算
(1)反应后生成铜的质量;
(2)原Fe2(SO4)3溶液的物质的量浓度。
某厂每天产生800m3含氮的废水(NH3的含量为168mg∙L-1)。该厂处理废水的方法是:将废水加热得到NH3,使废水中NH3的含量降为15mg∙L-1(假设废水处理前后体积不变)。再对加热蒸发得到的NH3进一步处理制取硝酸。
(1)制取硝酸过程中主要发生反应如下:①_________________,②4NO+3O2+2H2O=4HNO3。反应①是氨气在一定条件下被氧气氧化,请在横线上写出该反应的化学方程式。
(2)该厂每天通过加热蒸发可得到NH3的物质的量是__________________。
(3)若在反应①中N元素损失10%,则该厂每天可生产硝酸多少吨?(写出计算过程,结果保留2位小数)
氢气是化工行业重要原料之一。
(1)电解饱和食盐水是生产H2的方法之一。常温下,电解250 mL饱和食盐水一段时间后,溶液质量减轻0.365 g(假设气体全部逸出)。生成的氢气在标准状况下的体积为 mL。
(2)在电弧炉中,甲烷裂解产生乙炔和氢气,若1 m3 甲烷经此过程生成0.27 m3氢气,则甲烷的裂解率为 %(体积均在相同条件下测定)。
(3)已知:CxHy + H2O → CO + CO2 + H2(未配平)。工业上用甲烷、乙烷的混合气体利用上述反应生产氢气,反应后气体经干燥组成如下表所示:
| 组分 |
CO |
CO2 |
H2 |
| 体积分数 |
20% |
5% |
75% |
计算原混合气体中甲烷与乙烷的物质的量之比。
(4)合成氨生产过程中,消耗氮氢混合气2000 m3(其中CH4的体积分数为0.112%,下同),分离液氨后的氮氢混合气中含CH4 2.8%。计算分离出液氨为多少吨(保留2位小数,所有体积均已折算至标准状况)。
碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·xH2O]常用作塑料阻燃剂。
(1)碱式碳酸铝镁具有阻燃作用,是由于其受热分解需吸收大量热量和 。
(2)MgaAlb(OH)c(CO3)d·xH2O中a、b、c、d的代数关系式为 。
(3)为确定碱式碳酸铝镁的组成,进行如下实验:
①准确称取3.390g样品与足量稀盐酸充分反应,生成CO20.560L(已换算成标准状况下)。②另取一定量样品在空气中加热,样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如右图所示(样品在2700C时已完全失去结晶水,6000C以上残留固体为金属氧化物的混合物)。
根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-): n(CO32-)(写出计算过程)。
通常情况下,CO与O2的混合气体m L,用电火花引燃后体积变为n L(在相同条件下测定)。
(1)试确定原混合气体中CO与O2的体积。
(2)若反应后的气体密度在相同条件下为氢气的15倍时,试确定反应气体的组成及体积之比。
(12分)化学需氧量(COD)常作为衡量水体中有机物含量多少的指标。某化学课外小组的同学拟采用碱性高锰酸钾溶液测定某海水试样的COD,实验流程如下:
已知:①弱碱性条件下MnO4-被还原性物质还原为MnO2
②10I-+2MnO4-+16H+=5I2+2Mn2++8H2O
③2S2O32-+I2=2I-+S4O62-
(1)测定海水试样的COD,采用碱性高锰酸钾溶液而不采用酸性高锰酸钾溶液,其可能原因是。
(2)氧化后的水样煮沸后,需冷却并在暗处再加入KI和硫酸,需在暗处的原因是。用Na2S2O3,标准溶液滴定,终点时溶液颜色的变化是。
(3)滴定到终点时消耗Na2S2O3标准溶液10.00mL。根据以上实验数据计算海水试样的COD(用每升水样相当于消耗多少毫克O2表示,单位:mg•L-1)(写出计算过程)。