请根据化学方程式计算:
(1)完全中和0.3 mol氢氧化钠,需要硫酸的物质的量是多少?需要物质的量浓度为3 mol·L-1 稀硫酸多少升?(要求写出计算过程)
(2)质量分数为98%、密度为1.84 g·mL-1的浓硫酸的物质的量浓度是多少?若有此浓硫酸来稀释成3 mol·L-1稀硫酸,需要该浓硫酸多少毫升?(要求写出计算过程)
将250mL密度1.31g/cm3、质量分数为15﹪的硫酸与适量的铁屑充分反应。计算:
(1)此硫酸溶液中H2SO4的物质的量浓度;
(2)生成的H2的体积(标况);
(3)将生成的FeSO4配成400mL溶液,此溶液中Fe2+的物质的量浓度
制纯碱包括石灰石分解、粗盐水精制、氨盐水碳酸化等基本步骤。完成下列计算:
(1)CaCO3质量分数为0.90的石灰石100kg完成分解产生CO2 L(标准状况下)。
(2)石灰窑中,该石灰石100kg与焦炭混合焙烧,产生CO2 29120L(标准状况下),如果石灰石中碳酸钙完全分解,且焦炭完全燃烧,不产生CO,则焦炭的物质的量为 mol。
(3)已知粗盐水含MgCl2 6.80mol/m3,含CaCl2 3.00mol/m3。向粗盐水中加入Ca(OH)2除镁离子:MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2,然后加入Na2CO3除钙离子。处理上述粗盐水10m3,至少需要加Na2CO3 g。
(4)如果用碳酸化尾气(含NH3体积分数为0.100、CO2体积分数0.040)代替碳酸钠,发生如下反应:Ca2++2NH3+CO2+H2O=CaCO3↓+2NH4+。处理上述10m3粗盐水至少需要通入 L(标准状况下)碳酸化尾气。
若25℃时,CH3 COOH的电离平衡常数Ka = 1.8×10-5,则该温度下0.18mol/L的CH3 COONa溶液的pH= (CH3 COONa水解程度很小,计算时可将CH3COO-的平衡浓度看成是CH3 COONa溶液的浓度)
下图为某浓盐酸试剂瓶标签上的部分数据.请列式计算回答下列问题:
(1)该浓盐酸的物质的量浓度是多少?
(2)500mL该盐酸中溶解了标准状况下的HCl气体多少升?
(3)用该浓盐酸,与蒸馏水配制成体积比为1:4的稀盐酸,则所配制稀盐酸的质量分数为多少?(计算结果保留3位有效数字)
砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等.回答下列问题:
(1)写出基态As原子的核外电子排布式________.
(2)根据元素周期律,原子半径Ga________As,第一电离能Ga________As.(填"大于"或"小于")
(3) 分子的立体构型为________,其中As的杂化轨道类型为________.
(4) 的熔点高于1000℃, 的熔点为77.9℃,其原因是________.
(5)GaAs的熔点为1238℃,密度为 , 其晶胞结构如图所示.
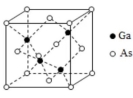
该晶体的类型为________,Ga与As以________键键合.Ga和As的摩尔质量分别为 和 , 原子半径分别为 和 ,阿伏伽德罗常数值为 ,则GaAs晶胞中原子的体积占晶胞体积的百分率为________.
某元素的核素为 X,其氯化物XCl2 1.11 g配成溶液后,需用20 mL 1 mol·L-1的AgNO3溶液才能把氯离子完全沉淀下来。已知X核素中有20个中子。
X,其氯化物XCl2 1.11 g配成溶液后,需用20 mL 1 mol·L-1的AgNO3溶液才能把氯离子完全沉淀下来。已知X核素中有20个中子。
(1)计算X的质量数为多少?
(2)指出X元素在周期表中的位置。
0.1mol某烃的衍生物与0.35mol氧气混合密闭于一容器中,点火后发生不完全燃烧,得到CO2、CO和H2O的气态混合物。将混合气体通过浓硫酸时,浓硫酸质量增加了5.4g,通过足量澄清石灰水时,可得到沉淀20g(干燥后称量)。剩余气体与灼热的氧化铁充分反应后再通入足量澄清的石灰水中,又得到20g固体物质(干燥后)。
求:(1)该有机物的分子式。
(2)该有机物可与醇发生酯化反应,且可使溴水褪色,写出该有机物可能的结构简式和名称。
将2.5g碳酸钠、碳酸氢钠和氢氧化钠固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:
(1)按顺序写出OA 段所发生反应的离子方程式_______________________。
(2)加人35mL盐酸时,产生二氧化碳的体积为___________mL
(3)计算原混合物中Na2CO3的质量(要求写出计算过程)
计算题:将0.2molMg、Al的混合物用盐酸完全溶解,放出标准状况下5.6L气体,然后再滴入2mol/LNaOH溶液,请回答:
(1)求该混合物中Mg、Al的物质的量?(写计算过程)
(2)若该Mg、Al的混合物与盐酸恰好完全反应,在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V= ml。
(3)若该Mg、Al混合物溶于200ml 3mol/L盐酸后,滴入NaOH溶液,使所得沉淀中无Al(OH)3,则滴入NaOH溶液的体积最少为 ml。
将一定质量的镁、铝合金,投入100 mL一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加5 mol/L NaOH溶液,生成的沉淀质量与加入NaOH溶液体积如图所示,由图中数据分析计算:

(1)原合金中镁的质量为 ;
(2)盐酸的物质的量浓度为 。
(1)在标准状况下4.48L CH4和CO2混合气体的质量为6.0g,则混合气体平均摩尔质量为 g/mol,相对于氢气的密度为 ;CH4和CO2的质量比为 .
(2)相同体积、相同物质的量浓度的AgNO3溶液,分别与相同体积的KCl、CuCl2、AlCl3溶液反应恰好完全反应,则KCl、CuCl2、AlCl3三种溶液的物质的量浓度之比为 。
(3)标准状况下,V L的某气体(摩尔质量为M g•mol﹣1)溶解在1L水(水的密度近似为1g•cm﹣3)中,假设气体完全溶解且不与水发生反应,溶液的密度为ρg•cm﹣3,则所得溶液的物质的量浓度c= mol/L.(选择以上字母表达计算式,要求化简).
一定温度下在某定容容器中发生反应:2A(g)+3B(g)===2C(g),开始时,A的浓度为
3 mol·L -1,B的浓度是5 mol·L-1,2 min后,B的浓度减少1.2 mol·L-1,则
(1)v(C)= 。
(2)在2min末,B的浓度是 ____________。