现有物质的量浓度均为 0.1 mol·L - 1 的下列五种物质的溶液:①HCl ②H2SO4 ③CH3COOH ④NH4Cl ⑤NaOH。其溶液中由水电离出的c(H+)的大小关系是
| A.① = ②>③>④>⑤ | B.④>③>①= ⑤>② |
| C.③>①>②>④>⑤ | D.④>③>①>⑤>② |
除去乙酸乙酯中残留的乙酸,有效的处理方法是
| A.蒸馏 |
| B.水洗后分液 |
| C.用过量饱和碳酸钠溶液洗涤后分液 |
| D.用过量氯化钠溶液洗涤后分液 |
下列离子方程式书写正确的是
| A.铜粉加入稀硝酸中:Cu+2H+= Cu2++H2↑ |
| B.钠投入水中:Na+H2O =Na++2OH一+H2↑ |
| C.氯化铝溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+ |
| D.氢氧化铝与稀硫酸反应:OHˉ+ H+=H2O |
某10% NaOH溶液,加热蒸发掉100 g水后得到100 mL 15%的溶液,则该15% NaOH溶液的物质的量浓度为
| A.6.25 mol/L | B.7 mol/L | C.7.5 mol/L | D.12.5 mol/L |
根据下列反应判断有关物质还原性由强到弱的顺序是
H2SO3+I2+H2O=H2SO4+2HI
2FeCl3+2HI=2FeCl2+2HCl+I2
3FeCl2+4HNO3=2FeCl3+NO↑+2H2O+Fe(NO3)3
| A.Fe2+>I->H2SO3>NO | B.I->Fe2+>H2SO3>NO |
| C.H2SO3>I->Fe2+>NO | D.NO>Fe2+>H2SO3>I- |
下列离子方程式书写正确的是
| A.铁和稀硫酸反应:2Fe+6H+=2Fe3+ +3H2↑ |
| B.碳酸镁和盐酸反应:MgCO3+2H+= Mg2+ +CO2↑+H2O |
| C.铜和硝酸银溶液反应:Cu+Ag+=Cu2+ +Ag |
| D.硫酸镁溶液与氢氧化钡溶液反应: SO42-+Ba2+═BaSO4↓ |
铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相同时,反应中消耗的HCl和NaOH的物质的量之比为
| A.3∶1 | B.1∶1 | C.2∶1 | D.1∶3 |
由CH4和O2组成的混合气体,标准状况下的密度为1.25g·L-1,则该混合气体中CH4和O2的体积比为
| A.2:1 | B.1:2 | C.1:3 | D.3:2 |
下列说法中不正确的是
| A.标准状况下,22.4L氦气含有所含的原子数约为6.02×1023 |
B.标准状况下,aL的二氧化碳和氮气的混合物含有的分子数约为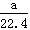 ×6.02×1023 ×6.02×1023 |
| C.22 g二氧化碳与标准状况下11.2 L 氯化氢气体含有的分子数相同 |
| D.标准状况下,2.24L CCl4中含有的原子数约为0.5×6.02×1023 |
粗盐中含可溶性CaCl2、MgCl2及Na2SO4,除去这些杂质的试剂可选用①Na2CO3、②NaOH、③BaCl2、④HCl,加入的先后顺序可以是
| A.①②③④ | B.②③①④ | C.②①③④ | D.①③②④ |