盐卤中除含有Mg2+、Cl-外,还含有少量Na+、Fe2+、Fe3+、SO42-和CO(NH2)2等。从海水提取食盐和Br2后的盐卤中可以提取MgCl2、MgO、Mg(OH)2等物质,制备流程如图所示:
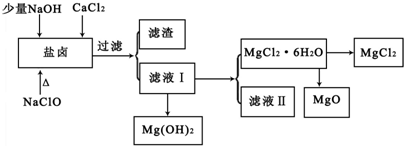
(1)从MgCl2溶液得到MgCl2.6H2O晶体的过程中所需的基本操作顺序依次为_________________ ;
A.加热蒸馏B.加热浓缩C.冷却结晶D.趁热过滤 E.过滤洗涤
(2)制取无水氯化镁必须在氯化氢存在的条件下进行,原因是____________(用适当的文字结合化学用语说明)。
(3)用NaClO除去尿素CO(NH2)2时,生成物除盐外,都是能参与大气循环的物质,则该反应的化学方程式为_________________ ;加入NaClO的另一个作用是_________________。
(4)Mg(OH)2是制镁盐、耐火材料和阻燃剂的重要原料.
已知25℃时Ksp[Mg(OH)2]=5.6×10-12,且Mg(OH)2(s)═MgO(s)+H2O(s)△H=+81.5kJ/mol.
①下列叙述正确的是_________
A.从盐卤或海水中获得Mg(OH)2,工业上选择NaOH作沉淀剂
B.Mg(OH)2能作阻燃剂的原因是它分解吸热且生成MgO覆盖可燃物
C.可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁
②酸碱指示剂百里酚蓝变色的pH范围如下:
| pH |
<8.0 |
8.0~9.6 |
>9.6 |
| 颜色 |
黄色 |
绿色 |
蓝色 |
25℃时,在Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为______。
某溶液可能含有Na+、Ag+、Al3+、S2-、CO32-、SO42-、NO3-等离子中的数种。向此溶液中加入稀盐酸,有浅黄色沉淀和气体出现,此溶液的焰色为黄色.根据以上实验现象,下列关于原溶液中离子成分的推测正确的是( )
| A.一定有S2-、SO32-、Na+ | B.一定没有Ag+、Al3+ |
| C.可能只有Na+、S2-、CO32- | D.一定有Na+、S2-、NO3 |
中国沿海某城市采用反渗透法将海水淡化,得到淡水供市民使用,剩余母液继续加工获得其他产品。母液中主要含有Cl-、Na+、K+、Ca2+、SO42-、Br-等离子。某实验小组同学模拟工业生产流程,进行如下实验.
(1)写出实验室制备氯气的化学方程式_____________________;
(2)海水淡化的方法还有____________(写出一种);
(3)I中,电解饱和食盐水的工业生产叫做氯碱工业,写出该反应的离子方程式__________;
(4)Cl2和Br2均为双原子分子,从原子结构的角度解释其原因_____________________;
(5)Ⅲ中,加入适量CaCl2固体的目的是_____________________;
(6)写出IV中反应的离子方程式_____________________;
(7)与过程II类似,工业上常用“空气吹出法”实现海水提溴,将1m3海水浓缩至1L,使用该法最终得到36g Br2,若提取率为60%,则原海水中溴的浓度为__________ mg/L。
海水中含有丰富的化学元素,下面是某化工厂从海水中提取NaCl、Mg(以MgCl2形式存在)和Br2(以NaBr的形式存在)及综合利用的生产流程简图:

请回答:
(1)在粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:
A.盐酸 B.氯化钡溶液 C.氢氧化钠溶液 D.碳酸钠溶液
则加入试剂的顺序是(填编号) 。
(2)Mg(OH) 2中加入盐酸后,要获得MgCl 2•6H 2O晶体,需要进行的实验操作依次 。
A.蒸馏 B.灼烧 C.过滤 D.蒸发 E.冷却结晶
(3)目前工业上主要采用离子交换膜法电解饱和食盐水,下列关于离子交换膜电解槽的叙述错误的是 .
A.精制饱和食盐水进入阳极室 B.纯水(加少量NaOH)进入阴极室
C.阴极产物为氢氧化钠和氢气 D.电解槽的阳极用金属铁网制成
(4)写出电解饱和NaCl溶液的离子方程式:
(5) 利用MgCl 2•6H 2O可制得无水氯化镁,应采取的措施是
(6) 用热空气吹出的溴蒸气可以用亚硫酸钠溶液吸收,写出反应的化学方程式:
粗盐中含有CaCl2、MgCl2、Na2SO4以及泥沙等杂质,请回答粗盐提纯的有关问题:
(1)NaCl既属于_______(填酸、碱或盐),也属于______(填强电解质或弱电解质),该分类方法称为_______,NaCl溶液中共含有________种微粒(包含分子和离子)
(2)为了除去可溶性杂质,可以按以下实验步骤进行提纯:①加过量BaCl2溶液;②加过量NaOH溶液;③加过量Na2CO3溶液;④过滤;⑤加适量盐酸.
其中,在步骤②中主要涉及的离子反应方程式是____________________________;步骤①和③能否交换顺序_______(填能或不能)。
(3)将ag粗盐样品溶于水,经过以上一系列提纯操作之后,实验完毕得到bg精盐(不考虑实验过程中操作引起的损耗),下列说法正确的是___________。(NA表示阿伏加德罗常数)
| A.粗盐中Na+数目为aNA/58.5 | B.精盐中NaCl物质的量为b/58.5mol |
| C.粗盐中NaCl的质量分数为b/a×100% | D.粗盐中关于NaCl的量无法确定 |
(4)某已滤去泥沙的粗盐经检验不含Na2SO4。该粗盐溶于水配成100mL溶液,加入过量稀NaOH溶液后,过滤得到沉淀Mg(OH)25.8g,滤液中通入CO2,得到如下图(横坐标表示通 入CO2标准状况下的体积,纵坐标表示沉淀的物质的量),回答下列问题:
①b段表示的离子方程式为__________
②100mL溶液中Ca2+的物质的量与所加NaOH的物质的量之比为__________
③P点表示的CO2的体积为__________(标准状况下)。
某澄清透明溶液中只可能含有:Al3+、Mg2+、Fe3+、Fe2+、H+、CO32-、NO3-中的几种,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示.则该溶液中一定含有的离子是( )

| A.Mg2+、 H+、NO3- |
| B.Mg2+、Fe3+、H+、NO3- |
| C.Fe3+、 H+、 NO3- |
| D.Cu2+、H+、 NO3- |
海水中蕴藏着丰富的资源。海水综合利用的流程图如下。

(1)粗盐中含Ca2+、Mg2+、Fe3+、SO42—及泥沙等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④调节溶液的pH等于7;⑤溶解;⑥过滤; ⑦蒸发。正确的操作顺序是 (填写序号字母)。
| A.⑤①③②④⑥⑦ | B.⑤①②③⑥④⑦ |
| C.⑤③①②⑥④⑦ | D.⑤③②①⑥④⑦ |
(2)NaCl做原料可以得到多种产品。
①工业上由金属钠制备过氧化钠的方法是:将金属钠迅速升温至熔化,并控制温度在300–400℃,通入经处理过的空气可制得过氧化钠,处理空气的目的是 。工业生产中因温度过低而得不到纯净的过氧化钠,你认为可能含有的杂质是 (填化学式)。
② 实验室用惰性电极电解100 mL0.1 mol/LNaCl溶液,若阴阳两极均得到112 mL气体(标准状况),则所得溶液的pH为(常温下) (忽略反应前后溶液的体积变化)。
③ 电解氯化钠稀溶液可制备“84消毒液”,通电时氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式: 。
(3)分离出粗盐后的卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。
① 粗产品的溶液中含有Na+、Fe2+、Fe3+和Mn2+,需将Fe2+、Fe3+、Mn2+转化为沉淀除去。因此先向溶液中加入一种上述(1)中得到的物质NaClO,然后控制溶液的pH为 。
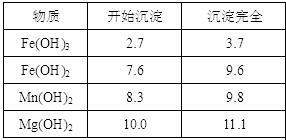
② 由MgCl2·6H2O晶体制备无水MgCl2的方法是 。
某无色混合气体可能由CH4、NH3、H2、CO、CO2和HCl中的某几种气体组成。在恒温恒压条件下,将此混合气体通过浓H2SO4时,总体积基本不变;通过过量的澄清石灰水,未见变浑浊,但混合气体的总体积减小,把剩余气体导出后,在O2中能够点燃,燃烧产物不能使CuSO4粉末变色。则原混合气体的成份是
( )
| A.HCl和CO | B.HCl、H2和CO | C.CH4和NH3 | D.HCl、CO和CO2 |
某KCl样品中含有少量K2CO3、K2SO4和不溶于水的杂质,为了提纯KCl,先将样品溶于适量水中,搅拌、过滤,再将滤液按下图所示步骤进行提纯(过滤操作已略去).下列说法的是( )

| A.起始滤液常温下pH=7 | B.试剂Ⅰ为Ba(NO3)2溶液 |
| C.上图过程须经2次过滤 | D.步骤③目的是除去CO32- |
过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:① 加入稍过量的Na2CO3溶液;② 加入稍过量的NaOH溶液;③ 加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤ 过滤 正确的操作顺序是 ( )
| A.③②①⑤④ | B.①②③⑤④ | C.②③①④⑤ | D.③⑤②①④ |
Ⅰ.羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫的危害,其分子结构和CO2相似。
(1)羰基硫(COS)的电子式为:______________。
(2)羰基硫(COS)用氢氧化钠溶液处理及利用的过程如下:
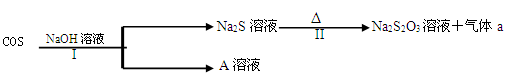
已知A是一种正盐,则A的化学式为______________;若气体a为单质,
反应II的离子方程式为________________________________________________。
Ⅱ.海水中含有丰富的镁资源。锂(Li)与镁元素性质相似。
(1)物质的量为0.10 mol的锂在只含有N2和O2混合气体的容器中燃烧,反应后容器内固体物质的质量m克,m的取值范围是 ;
(2)锂电池是新一代高能电池,目前已研究成功多种锂电池。某离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应为LiCoO2+C6 CoO2+LiC6,则放电时电池的正极反应为 。
CoO2+LiC6,则放电时电池的正极反应为 。
(3)为了回收废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过下列实验方法回收钴、锂。
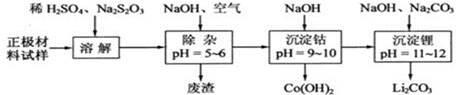
①在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中的化学反应方程式为 。
②调整pH=5-6的目的是 。
常温下,pH=1的某溶液A中含有NH4+、K+、Na+、Fe2+、Al3+、Fe3+、CO32-、NO3-、Cl-、I-、SO42-中的几种,现取该溶液进行有关实验,实验结果如下图所示:
回答下列问题:
(1)溶液A中一定不存在的阴离子有___________________
(2)生成沉淀甲和沉淀乙的离子方程式分别为___________________
(3)气体乙的结构式为_________________
(4)生成气体丙的离子方程式为__________________
若实验消耗Cu144g,则最多生成气体丁的体积(标准状况下)为__________。
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知有关原溶液中离子的说法不正确是( )
| A.SO42-、NH4+一定存在 |
| B.CO32-、Al3+、K+一定不存在 |
| C.Cl-一定存在,且c(Cl-)≥0.4mol/L |
| D.至少存在4种离子 |
下图为海水综合利用的工业流程图,判断下列说法正确的是
| A.过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质 |
| B.在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2 |
| C.在过程④、⑥反应中每氧化0.2 mol Br-需消耗0.1mol Cl2 |
| D.除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
常温下,某溶液A中可能含有NH4+、Na+、Al3+、Fe2+、Fe3+、CO32-、SO32-、Cl-、SO42-,现取该溶液进行相关实验,实验结果如图所示:
下列有关说法正确的是
| A.溶液中一定有SO42-,可能有Cl- |
| B.溶液中一定不存在的只有Fe2+和CO32- 两种离子 |
| C.溶液中一定存在Al3+、Na+ |
| D.生成的甲、乙两种气体均无色,且均易溶于水 |