(物质结构与性质)
Ⅰ.下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
试回答下列问题:
(1)请写出元素D的基态原子电子排布式___________________。
(2)元素A、B形成的单质中,______对应的单质熔点更高,原因是_________________。
(3)写出C的最高价氧化物的水化物与B的最高价氧化物的水化物反应的化学方程式_______________。
(4)元素D可以形成化学式为D(NH3)5BrSO4,配位数均为6的两种配合物。若往其中一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则该配合物的化学式为____________。
Ⅱ.钇钡铜氧的晶胞结构如图。研究发现,此高温超导体中的铜元素有两种价态:+2价和+3价。
(5)根据图示晶胞结构,推算晶体中Y,Ba,Cu和O原子个数比,确定其化学式为________。
Ⅲ.BF3与一定量的水形成晶体Q [(H2O)2·BF3],Q在一定条件下可转化为R: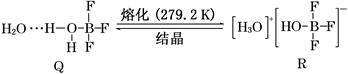
(6)晶体Q中各种微粒间的作用力不涉及________(填字母)。
a.离子键
b.共价键
c.配位键
d.金属键
e.氢键
f.范德华力
(7)R中阳离子的空间构型为________,阴离子的中心原子轨道采用_____杂化。
X、Y、Z、M、W是原子序数依次增大的前四周期元素,X元素原子核外有三个能级,各能级电子数相等,Y的单质在空气中燃烧生成一种淡黄色的固体;Z元素原子的最外层电子数比次外层电子数少2,M原子外围电子排布式为3dn4sn;W的内层电子已全充满,最外层只有2个电子。请回答:
(1)X元素在周期表中的位置是 ;
W2+离子的外围电子排布式为 。
(2)X 能与氢、氮、氧三种元素构成化合物 XO(NH2)2,其中X原子和N原子的杂化方式为分别为 、 ,该化合物分子中的 键与
键与 键的个数之比是 ;该物质易溶于水的主要原因是 。
键的个数之比是 ;该物质易溶于水的主要原因是 。
(3)已知Be和Al元素处于周期表中对角线位置,化学性质相似,请写出Y元素与Be的最高价氧化物的水化物相互反应的化学方程式
(4)M晶体的原子堆积方式为六方堆积(如图所示),则晶体中M原子配位数是 。某M配合物化学式是[M(H2O)5Cl]Cl2·H2O,1 mol该配合物中含配位键的数目是 。
(5)X 的某种晶体为层状结构,可与熔融金属钾作用。钾原子填充在各层之间,形成间隙化合物,其常见结构的平面投影如图①所示,则其化学式可表示为 。
(6)Y离子和Z离子比较,半径较大的是___(写离子符号),元素Y与元素Z形成的晶体的晶胞结构是如图②所示的正方体,设晶胞中最近的两个Z离子的距离为a cm ,该化合物的摩尔质量为bg/ mol ,则该晶胞密度的计算式为 。(只要求列算式,不必计算出数值,阿伏伽德罗常数用NA表示)。