福建省福州市八县高二下学期联考化学试卷
生活中的下列现象与原子核外电子发生跃迁有关的是
| A.钢铁长期使用后生锈 | B.节日里燃放的焰火 |
| C.金属导线可以导电 | D.卫生丸久置后消失 |
下列化学用语的表述不正确的是
| A.过氧化氢的结构式:H—O—O—H |
B.氮原子的L层电子轨道表示式: |
C.CO2的比例模型: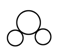 |
D.Cl-的结构示意图: |
只有在化合物中才能存在的化学键是
①离子键 ②氢键 ③共价键 ④极性键 ⑤非极性键
| A.①④ | B.①②④ | C.③⑤ | D.①③⑤ |
下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是
| A.半导体材料砷化镓 | B.吸氢材料镧镍合金 |
| C.透明陶瓷材料硒化锌 | D.超导材料K3C60 |
下列说法或有关化学用语的表达正确的是
| A.在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量 |
| B.核外电子排布由1s22s22p63s1―→1s22s22p6的变化需要吸收能量 |
| C.因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 |
| D.根据原子核外电子排布的特点,Cu在周期表中属于s区元素 |
根据下表给出的几种物质的熔点、沸点数据判断说法中错误的是
| A.SiCl4是分子晶体 |
| B.MgCl2中键的强度比NaCl中键的强度小 |
| C.单质R可能是原子晶体 |
| D.AlCl3为离子晶体 |
居室装修用石材的放射性常用22688Ra作为标准,居里夫人(Marie Curie)因对Ra元素的研究两度获得诺贝尔奖。下列叙述中正确的是
| A.RaCl2的熔点比CaCl2高 |
| B.Ra元素位于元素周期表中第六周期ⅡA族 |
| C.一个22688Ra原子中含有138个中子 |
| D.Ra(OH)2是一种两性氢氧化物 |
根据"相似相溶"规律,你认为下列物质在水中溶解度较大的是
| A.乙烯 | B.二氧化碳 | C.二氧化硫 | D.氢气 |
下列有关晶体和非晶体的说法中正确的是
| A.具有规则几何外形的固体均为晶体 |
| B.晶体具有自范性,有固定的熔点,可以使X光发生有规律的衍射 |
| C.晶体研碎后即变为非晶体 |
| D.将玻璃加工成规则的固体即变成晶体 |
下表所列物质晶体的类型全部正确的一组是
| 晶体类型 |
原子晶体 |
离子晶体 |
分子晶体 |
| A. |
氮化硅 |
磷酸 |
单质硫 |
| B. |
单晶硅 |
碳酸氢铵 |
水银 |
| C. |
金刚石 |
烧碱 |
冰 |
| D. |
铁 |
尿素 |
冰醋酸 |
已知X、Y为第三周期非金属元素(稀有气体除外),且电负性X>Y,下列说法错误的是
| A.X与Y形成化合物时,X可能显负价,也可能显正价 |
| B.第一电离能X可能小于Y |
| C.X的最高价含氧酸的酸性强于Y的最高价含氧酸的酸性 |
| D.原子序数X一定大于Y |
SF6是一种优良的绝缘气体,分子结构中只存在S-F键。已知断裂lmol F-F、S-F键需吸收的能量分别为l60kJ、330kJ.又知:1mol S(s)转化成气态S原子时吸收280 kJ能量,则S(s)+ 3F2(g)===SF6(g)的反应热为
| A.-770 kJ/mol | B.-l220 kJ/mol |
| C.-1500kJ/mol | D.-2740kJ/mol |
X、Y、Z、W是原子序数依次增大的四种短周期元素.其中只有一种是金属元素,X、W同主族且能形成一种离子化合物WX;Y的气态氢化物、最高价氧化物的水化物可反应生成一种盐;Z原子的最外层电子数与其电子总数之比为3︰4。下列说法中正确的是
| A.原子半径:W>Z>Y>X |
| B.氢化物稳定性:Y>Z |
| C.WY3中只有离子键没有共价键 |
| D.X与Z可形成l0电子分子和18电子分子 |
根据科学人员探测:在海洋深处的沉积物中含有可燃冰,主要成分是甲烷水合物.其组成的两种分子的下列说法正确的是
| A.它们都是极性键形成的极性分子 |
| B.它们的成键方式都只有σ键 |
| C.可燃冰的存在说明甲烷和水分子间能形成氢键 |
| D.它们的分子空间构型都相同 |
下列说法中正确的是
| A.乙烯中C=C的键能是乙烷中C—C的键能的2倍 |
| B.同一原子中,2p,3p,4p能级的轨道数目依次增多 |
| C.C—O键的极性比N—O键的极性大 |
| D.根据能量最低原理,原子的核外电子排布先填满离核近的轨道,再填充离核远的轨道 |
下列不能形成配位键的组合是
| A.Ag+、NH3 | B.BF3、NH3 | C.Co3+、CO | D.Ag+、H+ |
下列关于丙烯(CH3—CH =CH2)的说法正确的
| A.丙烯分子中3个碳原子都是sp3杂化 |
| B.丙烯分子存在非极性键 |
| C.丙烯分子有6个σ键,1个π键 |
| D.丙烯分子中3个碳原子在同一直线上 |
下列选项中,都是只由极性键形成的非极性分子的一组物质是
| A.BCl3、CS2、SO3 | B.CH4、CH2Cl2、BeCl2 |
| C.P4、SiO2、CO2 | D.NF3、CCl4、苯(C6H6) |
下列各组微粒的空间构型相同的是
①NH3和H2O ②NH4+和H3O+ ③NH3和H3O+ ④O3和SO2
⑤CO2和BeCl2 ⑥SiO44-和SO42- ⑦BF3和Al2Cl6
| A.全部 | B.除④⑥⑦以外 | C.③④⑤⑥ | D.②⑤⑥ |
C60可用作储存氢气的材料,结构如右图所示。继C60后,科学家又合成了Si60、N60,三种物质结构相似。下列有关说法正确的是
| A.C60、Si60、N60都属于原子晶体 |
| B.C60、Si60、N60分子内共用电子对数目相同 |
C.由于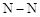 键能小于 键能小于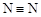 ,故N60的稳定性弱于N2 ,故N60的稳定性弱于N2 |
D.由于 键长小于 键长小于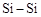 键,所以C60熔沸点低于Si60 键,所以C60熔沸点低于Si60 |
S2Cl2在合成橡胶、硬水软化等方面有着重要应用。将Cl2通入熔融的硫黄可制得S2Cl2,S2Cl2是黄红色油状发烟液体,遇水分解出无色有刺激性气味的气体,且溶液变浑浊。有关叙述正确的是
| A.在周期表中,氯元素位于硫元素之后,所以Cl2的氧化性弱于硫单质 |
| B.硫黄中只有非极性键,S2Cl2中只有极性键 |
| C.在常温常压下,硫黄是原子晶体,S2Cl2是分子晶体 |
| D.S2Cl2与水反应时,既体现氧化性又体现还原性 |
下列溶液中各含三种阳离子。若在溶液中加入少量氨水时,三种离子皆产生沉淀;加入过量氨水则三种沉淀皆溶解。符合条件的是
| A.Fe2+、Mg2+、Al3+ | B.Mg2+、Al3+、Cu2+ |
| C.Fe3+、Cu2+、Zn2+ | D.Ag+、Cu2+、Zn2+ |
当一个碳原子连接四个不同原子或原子团时,该碳原子叫做“手性碳原子”。下列化合物中含有2个手性碳原子的是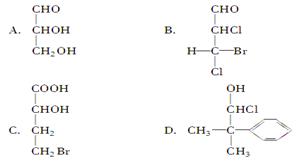
有关晶体的结构如下图所示,下列说法中错误的是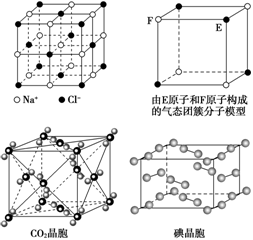
| A.在NaCl晶体中,距Na+最近的Cl-形成正八面体 |
| B.该气态团簇分子的分子式为EF或FE |
| C.在CO2晶体中,一个CO2分子周围有12个CO2分子紧邻 |
| D.在碘晶体中,碘分子的排列有两种不同的方向 |
X、Y、Z、M、W是原子序数依次增大的前四周期元素,X元素原子核外有三个能级,各能级电子数相等,Y的单质在空气中燃烧生成一种淡黄色的固体;Z元素原子的最外层电子数比次外层电子数少2,M原子外围电子排布式为3dn4sn;W的内层电子已全充满,最外层只有2个电子。请回答:
(1)X元素在周期表中的位置是 ;
W2+离子的外围电子排布式为 。
(2)X 能与氢、氮、氧三种元素构成化合物 XO(NH2)2,其中X原子和N原子的杂化方式为分别为 、 ,该化合物分子中的 键与
键与 键的个数之比是 ;该物质易溶于水的主要原因是 。
键的个数之比是 ;该物质易溶于水的主要原因是 。
(3)已知Be和Al元素处于周期表中对角线位置,化学性质相似,请写出Y元素与Be的最高价氧化物的水化物相互反应的化学方程式
(4)M晶体的原子堆积方式为六方堆积(如图所示),则晶体中M原子配位数是 。某M配合物化学式是[M(H2O)5Cl]Cl2·H2O,1 mol该配合物中含配位键的数目是 。
(5)X 的某种晶体为层状结构,可与熔融金属钾作用。钾原子填充在各层之间,形成间隙化合物,其常见结构的平面投影如图①所示,则其化学式可表示为 。
(6)Y离子和Z离子比较,半径较大的是___(写离子符号),元素Y与元素Z形成的晶体的晶胞结构是如图②所示的正方体,设晶胞中最近的两个Z离子的距离为a cm ,该化合物的摩尔质量为bg/ mol ,则该晶胞密度的计算式为 。(只要求列算式,不必计算出数值,阿伏伽德罗常数用NA表示)。
(12分)硼(B)及其化合物在化学中有重要的地位。请回答下列问题:
(1)Ga与B同主族,Ga的基态原子核外电子排布式为 B与同周期相邻两元素第一电离能由大到小的顺序是
(2)硼酸(H3BO3)是白色片状晶体(层状结构如图),有滑腻感,在冷水中溶解度很小,加热时溶解度增大。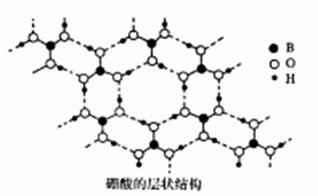
①硼酸中B原子的杂化轨道类型为 。
②硼酸晶体中存在的作用力有范德华力和 。
③加热时,硼酸的溶解度增大,主要原因是 。
④硼酸是一元弱酸,在水中电离时,硼酸结合水电离出的OHˉ 而呈酸性。写出硼酸的电离方程式_ 。
(3)立方氮化硼是一种新型陶瓷材料,结构和形体都类似金刚石,是现时所知的几乎最硬的物质,化学式为BN,则立方氮化硼中B原子的杂化轨道类型为 ;1mol立方氮化硼中B-N的物质的量为 。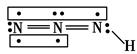
叠氮化物是一类重要化合物,氢叠氮酸(HN3)是一种弱酸,如图为分子结构示意图。肼(N2H4)被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2===2H2O+HN3。它的酸性类似于醋酸,可微弱电离出H+和N3-。
试回答下列问题:
(1)下列说法正确的是________(选填序号)。
A.酸性:HNO2>HNO3
B.N2H4中两个氮原子采用的都是sp2杂化
C.HN3、H2O都是极性分子
D.N2H4沸点高达113.5 ℃,说明肼分子间可形成氢键
(2)叠氮化物能与Fe3+、Cu2+及Co3+等形成配合物,如:[Co(N3)(NH3)5]SO4,在该配合物中钴显______价,根据价层电子对互斥理论可知SO42-的立体构型为________________,基态Fe原子有 个未成对电子,可用硫氰化钾检验Fe3+,形成的配合物的颜色为 。
(3)由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)===2Na(l)+3N2(g),下列说法正确的是________(选填序号)。
A.NaN3与KN3结构类似,前者晶格能较小
B.钠晶胞结构如上图,晶胞中分摊2个钠原子
C.氮的第一电离能大于氧
D.氮气常温下很稳定,是因为氮元素的电负性小
(4)与N3-互为等电子体的分子有:________ 、 ________(举二例),写出其中之一的电子式 。
(12分)Co、Cu、Zn都是过渡元素,可作为中心原子形成多种配合物
(1)下列不能作为配合物配位体的是( )
| A.H2O | B.NH3 | C.CH4 | D.Cl- |
(2)用氢键表示式写出氨水中NH3分子与水分子间形成的可能存在的氢键 。
(3)Cu元素可形成[Cu(NH3)4]SO4,其中存在的化学键类型有___ __(填序号)。
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
(4)若[Cu(H2O)4]2+具有对称的空间构型,且当其中的两个NH3被两个Cl-取代时,能得到两种不同结构的产物,则[Cu(H2O4]2+的空间构型为______(填字母)。
a.平面正方形 b.正四面体 c.三角锥型 d.V形
在硫酸铜溶液中逐滴滴加氨水至过量,先出现蓝色沉淀,最后沉淀溶解形成深蓝色的溶液。写出此蓝色沉淀溶解的离子方程式:___________________;
(5)把CoCl2溶解于水后加氨水直到先生成的Co(OH)2沉淀又溶解后,再继续加氨水,使之生成 [Co(NH3)6]2+。此时向溶液中通入空气,得到的产物中有一种的组成可用CoCl3·5NH3表示,把分离出的CoCl3·5NH3溶于水后立即加硝酸银溶液,则析出AgCl沉淀。经测定每1 mol CoCl3·5NH3只生成2 mol AgCl。请写出表示此配合物结构的结构简式:_____ ____。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号