【化学——物质结构与性质】
已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体。E的硫酸盐溶液是制备波尔多液的原料之一。回答下列问题(用元素符号或化学式表示)。
(1)M分子中B原子轨道的杂化类型为 ,
1mol M中含有σ键的数目为 。
(2)化合物CA3的沸点比化合物BA4的高,其主要原因是 。
(3)写出与BD2互为等电子体的C3-的结构式 。
(4)E+的核外电子排布式为 ,图12是E的某种氧化物的晶胞结构示意图,氧的配位数为 。
(5)向E的硫酸盐溶液中通入过量的CA3,写出该反应的离子方程式: 。
【化学——选修3:物质结构与性质】
已知X、Y和Z三种元素的原子序数之和等于48。X的一种1∶2型氢化物分子中既有σ键又有π键,所有原子共平面。Z是金属元素,Z的单质和化合物有广泛的用途。已知Z的核电荷数小于28,且次外层有2个未成对电子。工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐)。经X射线分析,M晶体的最小重复单元为正方体(如上图),顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2–所占。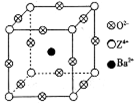
(1)Y2+的结构示意图________________;Z的价层电子排布式为____________。
(2)X在该氢化物中以_____________方式杂化;X和Y形成的化合物YX2的电子式为_____________________。
(3)①制备M的化学反应方程式是______________________________________;
②在M晶体中,若将Z4+置于立方体的体心,Ba2+置于立方体的顶点,则O2–处于立方体的_______________;
③已知O2–半径为1.4×10–10 m,Z4+的半径为6.15×10–11m,阿佛加德罗常数为NA,则M的密度为_______________g·cm–3。(不必化简)
【化学—物质结构与性质】
已知a、b、x、y、z五种元素的原子序数依次增大,其中a原子的半径是所有原子中半径最小的,b原子中的电子有6种不同的运动状态,y原子的L层有2对成对电子,z元素的电负性是前四周期中最小的。
(1)x、y两种元素的第一电离能的大小为x y(填“>”、“<”或“=”),用原子结构的知识解释原因 ;
(2)固体物质M的化学式为x a 5,它的所有原子最外层都符合相应的稀有气体原子的最外电子层结构。则该化合物中a元素的化合价为 和 ;该化合物中x原子的杂化方式为 ;
(3)如果把晶胞顶点与最近三个面心所围成的空隙叫做四面体空隙,z原子可作为容体掺入C60晶体的空隙中,形成具有良好的超导性的掺杂C60化合物。现把C60 抽象成质点,该晶体的晶胞结构如图所示,若每个四面体空隙填入一个z元素的原子,则 z元素全部填满C60晶体的四面体空隙后,所形成的掺杂C60化合物的化学式为 。
W、X、Y、Z为原子序数依次增大的四种短周期主族元素。其中,W的一种原子核内没有中子,Y的原子最外层电子数是其内层电子数的3倍。Y与Z能形成两种常见的离子化合物Z2Y和Z2Y2。X与Y能形成两种化合物,其相对分子质量之比为7 : 11。请回答:
(1)Z在元素周期表中的位置是____。
(2)X、Z两元素原子的次外层电子数之比为____。
(3)由W与X两种元素组成的物质甲,其相对分子质量为28。甲可能发生的反应有____(填序号)。
①与氢气反应 ②与氧气反应 ③与水反应 ④与酸性高锰酸钾溶液反应
(4)由W、X、Y三种元素组成的有机物乙,相对分子质量为60。由W、X、Y、Z四种元素组成的无机物丙,相对分子质量为84,受热易分解。又知,乙与丙反应能放出气体,写出乙溶液与丙溶液反应的化学方程式:____。
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加。其中A与B 、A与D在周期表中位置相邻,A原子核外有两个未成对电子,B元素的第一电离能比同周期相邻两个元素都大,C原子在同周期原子中半径最大(稀有气体除外);E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C、D四种元素电负性由大到小排列顺序为
(2)C形成的晶体中,其微粒堆积方式为 ;
(3)D单质的熔点很高,可用作计算机的核心部件,但会被氢氧化钠溶液腐蚀,其腐蚀的离子方程式为: ;D的氧化物在通讯方面有重要用途,90克D的氧化物中含共价键的数目为 。
(4)E核外电子排布式是 ,E的某种化合物的结构如图所示,则此化合物中各种粒子间的相互作用力有
【物质结构与性质】
组成蛋白质的元素主要有C、H、O、N及S、P和少量的Cu、Fe、Zn等,其中铜及其合金是人类最早使用的金属材料,用途广泛。
(1)铜原子的核外电子排布式是 ;O、N、S的第一电离能由大到小的顺序为 。
(2)铜的熔点比钙高,其原因是 ;
右图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为 。
(3)Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①[Cu(NH3)4]2+中存在的化学键类型有 (填序号)。
A.配位键B.金属键C.极性共价键D.非极性共价键E.离子键
②[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为 (填序号)。
A.平面正方形 B.正四面体 C.三角锥型 D.V型
③某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:
HOCH2CH=CH2→CH3CH2CHO。在丙烯醇分子中发生某种方式杂化的碳原子数是丙醛分子中发生同样方式杂化的碳原子数的2倍,则这类碳原子的杂化方式为 。
Ⅰ.顺铂是美国教授B Rosenberg等人于196 9年发现的第一种具有抗癌活性的金属配合物,它的化学式为Pt(NH3)2Cl2。1995年WHO对上百种治癌药物进行排名,顺铂的综合评价列第2位。
9年发现的第一种具有抗癌活性的金属配合物,它的化学式为Pt(NH3)2Cl2。1995年WHO对上百种治癌药物进行排名,顺铂的综合评价列第2位。
①顺铂中的配体有 。(写化学式)
②与NH3互为等电子体的分子、离子有 。
(至少各举一例)
③碳铂是1,1-环丁二羧酸二氨合铂(Ⅱ)的简称,是第二代铂族抗癌药物,其他毒副作用低于顺铂。碳铂的结构为:
碳 铂中含有的作用力有 。(填字母)
铂中含有的作用力有 。(填字母)
| A.极性共价键 | B.非极性共价键 | C.配位键 | D.离子键 |
E.金属键 F.σ键 G.π键
④碳铂的中心离子的配位数为 ,C原子的杂化方式有 ;
⑤铂(Pt)单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
晶胞中铂(Pt)原子的配位数为 。
Ⅱ.原子序数小于36的元素A和B,在周期表中既处于同一周期又位于同一族,且原子序数B比A多1,基态B原子中含有三个未成对电子。请写出A2+在基态时外围电子(价电子)排布式为 ,B元素在周期表中的位置为 。
“物质结构与性质”
(1)第ⅢA、ⅤA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。Ga原子的电子排布式为 。在GaN晶体中,与同一个Ga原子相连的N原子构成的空间构型为 。在四大晶体类型中,GaN属于 晶体。
(2)铜、铁元素能形成多种配合物。微粒间形成配位键的条件是:一方是能够提供孤电子对的原子或离子,另一方是具有 的原子或离子
(3)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:请回答下列问题:
① H、N、O三种元素的电负性由大到小的顺序是 。
②SO2分子的空间构型为 。与SnCl4互为等电子体的一种离子的化学式为 。
③乙二胺分子中氮原子轨道的杂化类型为 。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是 。
④⑶中所形成的配离子中含有的化学键类型有 。
a.配位键 b.极性键 c.离子键 d.非极性键
⑤CuCl的晶胞结构如右图所示,其中Cl原子的配位数为 。
有A、B、C、D、E、F六种元素。A是宇宙中最丰富的元素;B是周期表中电负性数值最大的元素;C的基态原子中2p轨道有三个未成对的单电子;F原子核外电子数是B与C核外电子数之和;D是主族元素,且与副族元素E同周期;E能分别形成红色(或砖红色)的E2O和黑色的EO两种氧化 物;D与B可形成离子化合物,其晶胞结构如右图所示。请回答下列问题。
物;D与B可形成离子化合物,其晶胞结构如右图所示。请回答下列问题。
(1)E元素原子基态时的外围电子排布式为 。
(2)A2F分子中F原子的杂化类型是 ,F的气态氧化物FO3分子的键角为 。
(3)CA3极易溶于水,其原因是 ,试判断CA3溶于水后,形成CA3·H2O的最合理结构为 (选填字母)。
(4)从晶胞结构图中可以看出,D跟B形成的离子化合物的电子式为 ;
该离子化合物晶体的密度为ρ(g·cm-3)。,则晶胞的体积是 (只要求列出算式)。
已知X、Y、Z、W是短周期中四种非金属元素,它们的原子序数依次增大。X元素原子形成的离子只有一个质子;Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体;Y原子的最外层电子数是内层电子数的2倍。
(1)写出下列字母所代表元素的名称:X ;Y ;Z ;W 。
(2)X单质和Z单质在一定条件下反应生成化合物E,写出该反应的化学方程式(并注明反应条件) ;Y单质和W单质(足量)在加热条件下反应生成化合物F,则F分子的空间构型为 ,电子式为 。
(3)这四种元素可组成X、Y、Z、W原子个数比为5∶1∶1∶3的化合物,该化合物的水溶液与足量浓NaOH溶液反应的离子方程式为:
___________________________________________________________________
.已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体。E的硫酸盐溶液是制备波尔多液的原料之一。回答下列问题(用元素符号或化学式表示)。
(1)M分子中B原子轨道的杂化类型为 ,1mol M中含有σ键的数目为 。
(2)化合物CA3的沸点比化合物BA4的高,其主要原因是 。
(3)写出与BD2互为等电子体的C3-的结构式 。
(4)E+的核外电子排布式为 ,下图是E的某种氧化物的晶胞结构示意图,氧的配位数为 。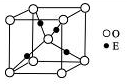
(5)向E的硫酸盐溶液中通入过量的CA3,写出该反应的离子方程式: 。
下表列出前20号元素中的某些元素性质的一些数据:
| 元素 性质 |
A |
B |
C |
D |
E |
F |
G |
H |
I |
J |
| 原子半径(10-10m) |
1、02 |
2、27 |
0、74 |
1、43 |
0、77 |
1、10 |
0、99 |
1、86 |
0、75 |
1、17 |
| 最高价态 |
+6 |
+1 |
— |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
+4 |
| 最低价态 |
-2 |
— |
-2 |
— |
-4 |
-3 |
-1 |
— |
-3 |
-4 |
试回答下列问题:
(1)已知H为Na元素,则以上10种元素中第一电离能最小的是: 。(写元素符号)。比元素B原子序数大10的元素其基态原子的核外电子排布式是 。
(2)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。其一分子中共形成 个σ键, 个π键。
(3)短周期某主族元素K的电离能情况如图(A)所示。则K元素位于周期表的第 族。
图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第 族元素氢化物的沸点的变化规律。
②不同同学对某主族元素的氢化物的沸点的变化趋势画出了两条折线—折线a和折线b,你认为正确的是 ,理由是 。
Ⅰ.氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)若知上述反应每产生2.24LCO气体(折为标准状况)放出Q kJ的热量,则其热化学方程式为 
(3)用轨道表示式表达Si 核外电子排布情况 
(4)已知Si的电负性为1.8 ,H的电负性为2.1,N的电负性为3.0 ,则SiH4中硅的化合价为 ,Si3N4所属的化合物类型是 (填离子化合物or共价化合物),在前四周期的元素中,未成对电子数最多的元素的电子排布式为
Ⅱ.用CH4催化还原NOx可以消除氮氧化物的污染 。例如:
。例如:
CH4(g) +4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
2N2(g)+CO2(g)+2H2O(g)=CH4(g)+4NO(g) ΔH=+1160 kJ·mol-1
若用标准状况下4.48LCH4还原NO2至N2,整个过程中转移的电子总数为 (阿伏伽德罗常数用NA表示),放出的热量为 kJ。
(17分)有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)A是________,B是________,E是_________。
(2)写出C元素基态原子的电子排布式_________________________。
(3)B 、D两种元素的氢化物中,沸点大的是 (写化学式号),其原因是
(4)元素B与D的电负性的大小关系是___________,C与E的第一电离能的大小关系是___________。(填“>”、“<”或“=”,用元素符号表示)
(5)E位于周期表的第 周期,第 族;其原子结构示意图为 。
(6)A与B形成的A2B2化合物含 键(填“极性”或“非极性”),属 分子。(填“极性”或“非极性”)其电子式为:______________________________。
下表中a、b、c…为周期表中部分元素,回答下列问
| a |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
f |
y |
h |
i |
|
| |
b |
|
|
|
|
|
|
|
|
|
|
e |
|
|
|
j |
|
| c |
|
|
|
|
|
|
d |
|
|
|
g |
|
l |
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)在表中用线画出元素周期表的边界
(2)请写出上述元素d3+的核外电子排布式 ;
(3)请比较y、h、i三种元素的第一电离能由大到小的顺序 (写元素符号),判断依据是:
(4)请写出e元素的原子价电子轨道表示式 ;
(5)ya3分子的电子式是 ,其分子的空间构型是 。
(6)e元素最高价氧化物对应的水化物呈_______性(酸性、碱性或两性),用离子方程式说明____________________________________________ 。