化合物F(匹伐他汀)用于高胆固醇血症的治疗,其合成路线如下:
(1)化合物D中官能团的名称为 、 和酯键。
(2)A→B的反应类型是 。
(3)写出同时满足下列条件的A的一种同分异构体的结构简式: 。
①分子中含有两个苯环;②分子中有3种不同化学环境的氢;③不含—O—O—。
(4)实现D→E的转化中,化合物X的分子式为C19H15NFBr,写出其结构简式: 。
(5)已知:化合物E在CF3COOH催化作用下先转化为 ,再转化为F。你认为合成路线中设计步骤②的目的是 。
,再转化为F。你认为合成路线中设计步骤②的目的是 。
(6)上述合成路线中,步骤③的产物除D外还生成 ,该反应原理在有机合成中具有广泛应用。试写出以
,该反应原理在有机合成中具有广泛应用。试写出以 为主要原料制备
为主要原料制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
莫沙朵林是一种镇痛药,它的合成路线如下:
(1)B中手性碳原子数为 ;化合物D中含氧官能团的名称为 。
(2)C与新制氢氧化铜反应的化学方程式为 。
(3)写出同时满足下列条件的E的一种同分异构体的结构简式: 。
①核磁共振氢谱有4个峰;
②能发生银镜反应和水解反应;
③能与FeCl3溶液发生显色反应。
(4)已知E+X F为加成反应,化合物X的结构简式为 。
F为加成反应,化合物X的结构简式为 。
(5)已知: 化合物
化合物 是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以
是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以 和
和 为原料合成该化合物(用合成路线流程图表示,并注明反应条件)。合成路线流程图示例如下:
为原料合成该化合物(用合成路线流程图表示,并注明反应条件)。合成路线流程图示例如下:
(1)为实现以下各步的转化,请在括号中填入适当的试剂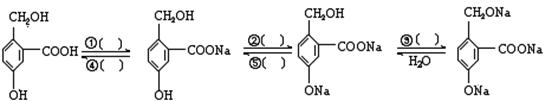
① ② ③ ④ ⑤
(2)分子式为C4H10O的有机化合物,能在催化剂作用下连续氧化生成羧酸,请写出它可能的结构简式为_____________ 、_____________ 。当C与4个不同的原子或基团相连时该碳原子称作“手性”碳原子。则分子式为C4H10O的有机化合物中,含有“手性”碳原子的结构简式为________________。该有机物的系统命名为:
已知有机物A和B都只含C、H、O三种元素。
(1)A的相对分子质量为62,A经催化氧化生成D,D经催化氧化生成E,A与E在一定条件下反应可生成一种环状化合物F。
则A的分子式为________,结构简式为________;A与E反应生成F的反应类型为________。
(2)对有机物B的组成、结构进行分析测定,得实验结果如下:
①完全燃烧166 mg有机物B,得到352 mg CO2和54 mg H2O;
②测出B的核磁共振氢谱有2个峰,红外光谱显示结构中含苯环和羧基;
③B的相对分子质量在100~200之间。
则B的相对分子质量为________,结构简式为________。
(3)A与B在一定条件下反应可生成一种常见合成纤维,该反应的化学方程式为________________。
有机物X含有碳、氢、氧三种元素。
(1)探究X与钠反应产生气体的成分。
①X与钠反应产生的气体具有可燃性。将气体点燃,把一干燥的小烧杯罩在火焰上,片刻在烧杯壁上出现液滴,迅速倒转烧杯,向烧杯中加入少量澄清石灰水,未见浑浊。则X与钠反应产生的气体为________。
②根据苯、乙烷等碳氢化合物不能与钠反应产生上述气体这一事实,可得出X分子里有不同于烃分子里的氢原子存在。即有机物X除含有碳氢键之外,还有的化学键是________键。
(2)工业上, X可由乙烯与水反应制得,则X的分子式是________。
X分子含有的官能团的名称是________。写出X发生催化氧化反应的化学方程式______________。
X能被酸性高锰酸钾或重铬酸钾氧化为生活中的另一种重要的有机化合物Y,X与Y发生反应的化学方程式是________________。为了提高该反应的反应速率,可采取的措施是_______________。可用某溶液除去产品中混有的杂质,写出除杂过程发生反应的化学反应方程式______________________。
ⅰ已知A是气态烃,完全燃烧时产生的CO2和H2O 的物质的量之比为1:1,A的相对分子质量小于30,在下图变化中,F为高分子化合物,C中含有-CHO,E有水果的香味(反应条件未写出)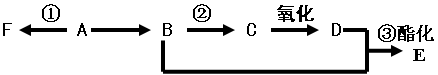
(1)B中所含官能团名称 ,E 物质的名称 ;
(2)反应①类型为 。
(3)写出下列反应的化学方程式(注明反应条件)
① ;
② ;
③ ;
ⅱ一定量的乙醇在氧气不足的情况下燃烧,得到CO、CO2和水的总质量为27.6g,若其中水的质量为10.8g,则CO的质量为 g.
ⅲ某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛(乙醛易溶于水),图中铁架台等装置已略去,粗黑线表示乳胶管。请填写下列空白: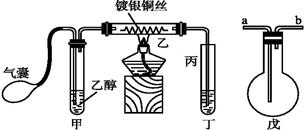
(1)甲装置常常浸在70~80 ℃的水浴中,目的是 。
(2)由于装置设计上的缺陷,实验进行时可能会 。
(3)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):
乙接 、 接丙。
已知乳酸的结构简式为: 
(1)则90g乳酸与足量金属钠反应产生的气体在标准状况下的体积是_____________L。
方程式为 。
已知两分子乳酸可在一定条件下反应生成环状的酯,写出该反应的方程式:
。
(2)已知葡萄糖可以和醋酸在一定条件下发生酯化反应,则1摩尔葡萄糖最多可以消耗
摩尔醋酸。
(3)分子式为C6H12的某烃,其所有的碳原子都一定在同一平面上,则该烃的结构简式为
__________________。
(4)某苯的同系物分子式为C11H16,苯环上只有一个取代基,其同分异构体共有 种。
(9分)已知同一个碳原子上连有两个羟基是不稳定的,会失水形成羰基。试回答下列问题:
(1)写出 在Ag存在和加热条件下与O2反应的化学方程式:
在Ag存在和加热条件下与O2反应的化学方程式:
________________________________________。
(2)写出丙炔与HBr按1∶2的加成产物(氢原子加在含氢较多的碳上)在碱性条件下完全水解后产物的结构简式:_____________________________。
(3)C5H12O分子属于醇类的同分异构体有______种,若向其中加入酸性高锰酸钾溶液无明显现象,则该醇的结构简式为________________。
现有A、B两种链状饱和一元醇的混合物0.3 mol,其质量为13.8g。已知①A和B碳原子数均不大于4,且A<B;②A和B分子中均不含有支链,且都能被催化氧化生成醛。
(1)混合物中A可能的分子式 ;B可能的分子式 。
(2)若n(A):n(B)=1:1时,A的名称 B的名称 。
(3)若n(A):n(B)≠1:1时,A的结构简式为 ;
B的结构简式为 。则n(A)∶n(B) = 。
A是化学实验室中常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应。
(1)写出A的化学式
(2)下列反应的化学方程式
反应①:
反应②:
反应③:
反应④:
(3)比较反应①与钠和水反应的现象有什么相同和不同
相同点:
不同点:
某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%, 其有三种性质不同的氢
(1)X的分子式是__________,官能团的名称
(2)X与金属钠反应放出氢气,反应的化学方程式是____ _____(有机物用结构简式表达)
(3)将铜丝放在空气中加热,然后伸入X中,整个过程的实验现象为
写出有关化学反应方程式
(4)X与足量的高锰酸钾酸性溶液反应可生成Z,Z的名称为__________ 。
(10分)近年来,国际原油价格大幅上涨,促使各国政府加大生物能源生产,其中酒精汽油已进入实用化阶段。
(1)乙醇在铜或银作催化剂的条件下,可以被空气中的氧气氧化成X,X可发生银镜反应,请写出X被银氨溶液氧化的反应方程式(标出具体反应条件):
。
(2)乙醇可以与酸性重铬酸钾溶液反应,被直接氧化成Y,Y含有官能团的名称是________。在浓硫酸存在下加热,乙醇与Y反应可生成一种有香味的物质W,化学方程式为 。
(3)现有两瓶无色液体,分别盛有Y、W,只用一种试剂就可以鉴别,该试剂可以是
(4)现代石油化工采用银作催化剂,乙烯能被氧气氧化生成环氧乙烷( ),该反应的原子利用率为100%,反应的化学方程式为 。
乙醇是我们生活中常接触到的一种有机化合物,根据你学过的乙醇的性质,回答下列有关的问题。
(1)饭店中常使用固体酒精,你判断它应是_______________(纯净物、混合物),质量较差的固体酒精在使用时因燃烧不充分,可能产生有毒气体____________(写分子式)。
(2)在焊接铜漆包线的线头时,常先把线头放在火上烧一下,以除去漆层,并立即在酒精中蘸一下就可得到光亮的铜线头,写出这个过程中发生反应的化学方程式:
________________________________
_________________________________
(3) 用硫酸酸化的CrO3遇酒精后,其颜色会从红色变为蓝绿色,用这个现象可以测得汽车司机是否酒后驾车。反应的化学方程式如下
2CrO3+3C2H5OH+3H2SO4→ Cr2(SO4)3+3CH3CHO+6H2O
该反应中,乙醇发生_________反应(填有机反应类型),
乙醇分子中的__ ____号键断裂(填图中序号),
产物CH3CHO的名称是______________,结构式为____________。
(本题共12分)乙醚极易挥发、微溶于水、是良好的有机溶剂。乙醇与浓硫酸的混合物在不同温度下反应能生成乙烯或乙醚。某实验小组用下图装置制取乙醚和乙烯。
1.制乙醚:在蒸馏烧瓶中先加入10 mL乙醇,慢慢加入10 mL浓硫酸,冷却,固定装置。加热到140℃时,打开分液漏斗活塞,继续滴加10 mL乙醇,并保持140℃,此时烧瓶c中收集到无色液体。
(1)Ⅰ和Ⅱ是反应发生装置,应该选择______(选答“Ⅰ”或“Ⅱ”)与装置Ⅲ相连。
(2)乙醇通过分液漏斗下端连接的长导管插入到液面下加入,目的有二,一是使反应物充分混合,二是_________________。
2.Ⅲ中水冷凝管的进水口是______(选答“a”或“b”)。冰盐水的作用是___________。
3.有同学认为以上装置还不够完善,一是溴水可能倒吸,二是尾气弥漫在空气中遇明火危险。该同学设计了以下几种装置与导管d连接,你认为合理的是(选填编号)_______。
4.反应一段时间后,升温到170℃,观察到反应物变为黑色,溴水褪色。写出实验过程中所有生成气体的反应方程式____________________________。
5.实验中收集到的乙醚产品中可能含有多种杂质。某同学设计了以下提纯方案:
(1)分液步骤除去产品中的酸性杂质,则X可以是________________。
(2)蒸馏操作可除去的杂质是____________。
6.工业乙醚常因接触空气和光而被氧化,含有少量过氧化物,除去过氧化物的试剂及操作分别是(选填编号)______________。
a.CCl4、萃取 b.Na2SO3溶液、分液
c.Na2SO4溶液、过滤 d.酸化的FeSO4溶液、分液