下图为实验室制备乙酸乙酯的装置。


 已知下列数据:
已知下列数据:
| 物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
| 乙醇 |
-114 |
78 |
0.789 |
| 乙酸 |
16.6 |
117.9 |
1.05 |
| 乙酸乙酯 |
-83.6 |
77.5 |
0.900 |
| 浓H2SO4 |
|
338 |
1.84 |
 (1)写出试管a中主要发生反应的化学方程式 。
(1)写出试管a中主要发生反应的化学方程式 。
(2)导管要插在试管b中饱和Na2CO3溶液的液面以上,原因是: 。
 (3)试管b中饱和Na2CO3的作用: 。
(3)试管b中饱和Na2CO3的作用: 。
 (4)开始用小火加热试管a中的混合液,其原因是__ 。
(4)开始用小火加热试管a中的混合液,其原因是__ 。
(5)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有 (填序号)。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
 (6)若120 g乙酸和184 g乙醇反应生成106 g 乙酸乙酯,则该反应的产率为________。
(6)若120 g乙酸和184 g乙醇反应生成106 g 乙酸乙酯,则该反应的产率为________。
羟基是重要的官能团。某化学小组以下列4种物质的溶液作为研究对象,比较不同物质的羟基中氢原子的活泼性。①碳酸 ②乙醇 ③苯酚 ④乙酸
I.甲同学设计并实施了如下实验方案,请完成(1)(2)(3)(4)的填空及结论。
| 编号 |
实验操作 |
实验现象 |
结论及解释 |
| 1 |
分别取4种溶液,滴加紫色石蕊溶液 |
溶液变红的是①④溶液 |
略 |
| 2 |
向含酚酞的NaOH溶液中,各滴加等量的②③两种溶液 |
②中无明显现象 ③中红色明显变浅 |
滴加③时反应的化学方程式: (1)___________ |
| 3 |
用一定浓度的醋酸溶液浸泡水垢(水垢主要成分为碳酸钙) |
(2)__________ |
略 |
| 4 |
将CO2通入C6H5ONa溶液中 |
(3)__________ |
反应的化学方程式: (4)_____________ |
| 结论: 4种物质的羟基中的氢原子的活泼性由强到弱的顺序是(填序号)_____________。 |
II.乙同学在研究了甲同学的实验方案后,提出如下改进方案,能一次比较乙酸、碳酸和苯酚的羟基中氢原子的活泼性,实验仪器如下图所示。

(1)利用上述仪器组装实验装置,其中A管插入(填字母,下同)_______中,B管插入E中,C管插入_________中。
(2)丙同学查资料发现乙酸有挥发性,于是在试管F之前增加了一个盛有_____________溶液的洗气装置,使乙同学的实验设计更加完善。
实验室制乙烯时,产生的气体能使Br2的四氯化碳溶液褪色,甲、乙同学用下列实验验证。(气密性已检验,部分夹持装置略)。

实验操作和现象:
| 操 作 |
现 象 |
| 点燃酒精灯,加热至170℃ |
Ⅰ:A中烧瓶内液体渐渐变黑 Ⅱ:B内气泡连续冒出,溶液逐渐褪色 |
| …… |
|
| 实验完毕,清洗烧瓶 |
Ⅲ:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
(1)烧瓶内产生乙烯的化学方程式是 。
(2)溶液“渐渐变黑”,说明浓硫酸具有 性。
(3)分析使B中溶液褪色的物质,甲认为是C2H4,乙认为不能排除SO2的作用。
①根据甲的观点,使B中溶液褪色反应的化学方程式是 。
②乙根据现象Ⅲ认为产生了SO2,在B中与SO2反应使溶液褪色的物质是 。
③为证实各自观点,甲、乙重新实验,设计与现象如下:
| |
设 计 |
现 象 |
| 甲 |
在A、B间增加一个装有某种试剂的洗气瓶 |
Br2的CCl4溶液褪色 |
| 乙 |
与A连接的装置如下: |
D中溶液由红棕色变为浅红棕色时,E中溶液褪色 |
a.根据甲的设计,洗气瓶中盛放的试剂是 。
b.根据乙的设计,C中盛放的试剂是 。
c.能说明确实是SO2使E中溶液褪色的实验是 。
d.乙为进一步验证其观点,取少量D中溶液,加入几滴BaCl2溶液,振荡,产生大量白色沉淀,浅红棕色消失,发生反应的离子方程式是 。
(4)上述实验得到的结论是 。
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:


可能用到的有关数据如下:
| |
相对分子质量 |
密度/(g·cm-3) |
沸点/℃ |
溶解性 |
| 环己醇 |
100 |
0.961 8 |
161 |
微溶于水 |
| 环己烯 |
82 |
0.810 2 |
83 |
难溶于水 |
合成反应:
在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置b的名称是_______________。
(2)加入碎瓷片的作用是________________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填正确答案标号)。
A.立即补加 B.冷却后补加
C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为______________。
(4)分液漏斗在使用前须清洗干净并________;在本实验分离过程中,产物应该从分液漏斗的________(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是_______________。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有________(填正确答案标号)。
A.圆底烧瓶
B.温度计
C.吸滤瓶
D.球形冷凝管
E.接收器
(7)本实验所得到的环己烯产率是____________(填正确答案标号)。
A.41% B.50% C.61% D.70%
(1)为进行Ⅰ项中的除杂实验(括号内为杂质),请从Ⅱ项中选出一种试剂,从Ⅲ项中选出一合适的实验操作方法分离,将标号填在后面的答案栏内。
| Ⅰ 除杂实验 |
Ⅱ 试剂 |
Ⅲ 操作方法 |
答案 |
||
| Ⅰ |
Ⅱ |
Ⅲ |
|||
| ①苯(苯酚) |
A.饱和Na2CO3溶液 B.NaCl晶体 C.NaOH溶液 D.CaO |
a.蒸馏 b.分液 c.盐析、过滤 d.萃取 |
① |
|
|
| ②乙醇(水) |
② |
|
|
||
| ③肥皂(甘油、水) |
③ |
|
|
||
| ④乙酸乙酯(乙酸) |
④ |
|
|
(2)如图均是由4个碳原子结合成的6种有机物(氢原子没有画出).
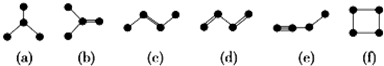
①有机物(a)有一种同分异构体,试写出其结构简式 .
②上述有机物中与(c)互为同分异构体的是 (填代号).
③任写一种与(e)互为同系物的有机物的结构简式 .
④(a)(b)(c)(d)(e)五种物质中,4个碳原子一定处于同一平面的有 (填代号).
(3)下列实验中,需要用水浴加热的是 ,
①新制Cu(OH)2与乙醛反应; ②银镜反应; ③溴乙烷的水解;
④乙酸和乙醇反应制乙酸乙酯;⑤由乙醇制乙烯;⑥苯的硝化
已知下列数据:
| 物质 |
熔点(℃) |
沸点(℃) |
密度(g·cm-3) |
| 乙醇 |
-117.0 |
78.0 |
0.79 |
| 乙酸 |
16.6 |
117.9 |
1.05 |
| 乙酸乙酯 |
-83.6 |
77.5 |
0.90 |
| 浓硫酸(98%) |
— |
338.0 |
1.84 |
学生在实验室制取乙酸乙酯的主要步骤如下:
①在30 mL的大试管A中按体积比1∶4∶4的比例配制浓硫酸、乙醇和乙酸的混合溶液;
②按下图连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10 min;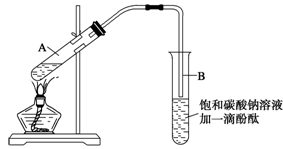
③待试管B收集到一定量的产物后停止加热,撤去试管B并用力振荡,然后静置待分层;
④分离出乙酸乙酯层、洗涤、干燥。
请根据题目要求回答下列问题:
(1)配制该混合溶液的主要操作步骤为_______________________。
写出制取乙酸乙酯的化学方程式:______________________。
(2)上述实验中饱和碳酸钠溶液的作用是(填字母)__________ __________。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热操作,其主要理由是________________________。
(4)分离出乙酸乙酯后,为了干燥乙酸乙酯可选用的干燥剂为(填字母)______。
A.P2O5 B.无水Na2SO4
C.碱石灰 D.NaOH固体
(共14分 )
(1)甲烷的结构式是 。乙烯的电子式是 。将6.72L(标准状况)乙烯和甲烷的混合气通入足量的溴水中,充分反应后,溴水的质量增加了1.4g,原混合气体中乙烯和甲烷的物质的量之比是______。
(2)在烷烃分子中,每增加一个碳原子,1mol烷烃完全燃烧需要多消耗氧气(填字母)________。
A.1mol B.1.5mol C.2mol D.2.5mol
(3)乙醇分子内有四种不同的化学键(如图) ,在不同的化学反应中会断裂不同的化学键,请写出下列反应的化学方程式,并指出反应时乙醇分子中断裂的化学键。
,在不同的化学反应中会断裂不同的化学键,请写出下列反应的化学方程式,并指出反应时乙醇分子中断裂的化学键。
A.乙醇在热的铜丝催化下发生氧化反应: ,断裂(填序号) 化学键;
B.乙醇中投入钠粒冒气泡: ,断裂(填序号) 化学键。
Ⅰ、醉驾对人们的安全危害很大,利用下列原理可以检查司机是否酒后开车。
2K2Cr2O7(橙色)+3C2H5OH+H2SO4 →Cr2(SO4)3(绿色)+K2SO4+CH3COOH+H2O
①配平化学方程式后,H2O前面的系数为 ;
②怎样判断司机是酒后开车: 。
③写出用粮食酿酒的化学方程式: ; 。
Ⅱ、下列框图中,A由两种黑色金属氧化物等物质的量混合而成,B中含有四种阳离子。据此回答下列问题:
(1)A的组成是 (填化学式)。
(2)相同条件下,溶液B中所有阳离子的氧化性由强到弱的顺序依次是 。
(3)A中某组分可由单质与水反应制得,化学方程式为: 。
(4)电解所用装置如图所示。
①电解开始阶段,阳极上的电极反应是 ,阴极上的电极反应是 。
②电解至阴极刚开始有固体R析出时,该溶液中金属离子浓度由大到小的顺序是 。
有关催化剂的催化机理等问题可以从“乙醇催化氧化实验”得到一些认识,某教师设计了如图所示装置(夹持装置等已省略),其实验操作为:先按图安装好装置,关闭活塞a、b、c,在铜丝的中间部分加热片刻,然后打开活塞a、b、c,通过控制活塞a和b,而有节奏(间歇性)地通入气体,即可在M处观察到明显的实验现象。试回答以下问题:
(1)A中发生反应的化学方程式:__________________,B的作用:_____________;C中热水的作用:_____________________。
(2)M处发生反应的化学方程式为_________________。
(3)从M管中可观察到的现象:_______________,从中可认识到该实验过程中催化剂 (填“参加”或“不参加”)化学反应,还可以认识到催化剂起催化作用需要一定的_____________。
(4)实验进行一段时间后,如果撤掉酒精灯,反应 ________ (填“能”或“不能”)继续进行,其原因是_____________。
(5)验证乙醇氧化产物的化学方法是______________________。
下图所示为某化学兴趣小组设计的乙醇催化氧化的实验装置(图中加热仪器、铁架台、铁夹等均未画出)。图中A试管盛有无水乙醇(沸点为78℃),B处为螺旋状的细铜丝,C处为无水硫酸铜粉末,干燥管D中盛有碱石灰,E为新制的氢氧化铜,F为氧气的发生装置。
(1)在实验过程中,需要加热的仪器(或区域)有(填仪器或区域的代号A~F)___。
(2)B处发生的化学反应方程式为________________。
(3)C处应出现的现象是_________________,
D处使用碱石灰的作用是__________________,
E处应出现的实验现象是 _____________________,
F处可以添加的固体药品是 ______________。
(4)若本实验中拿去F装置(包括其上附的单孔塞和导管),同时将A试管处原来的双孔塞换成单孔塞用以保证装置的气密性,其它操作不变,则发现C处无明显变化,而E处除了依然有上述(3)中所出现的现象之外,还有气体不断地逸出。由此推断此时B处发生反应的化学方程式为______________。
乙烯是来自石油的重要有机化工原料,其产量通常用来衡量一个国家的石油化工发展水平。结合以下路线回答: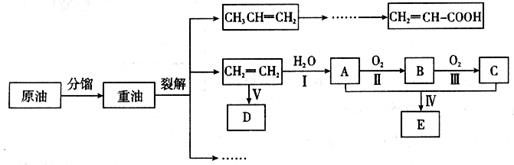
已知:
(1)写出A的电子式 。
(2)反应II的化学方程式是__________。
(3)D为高分子化合物,可以用来制造多种包装材料,其结构简式是__________。
(4)E是有香味的物质,在实验室用下图装置制取。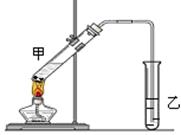
①反应IV的化学方程式是__________,该反应类型为______。
②该装置图中有一个明显的错误是 。
(5)为了证明浓硫酸在反应IV中起到了催化剂和吸水剂的作用,某同学利用上图改进后装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管乙再测有机层的厚度,实验记录如下:
| 实验编号 |
试管甲中试剂 |
试管乙中试剂 |
有机层的厚度/cm |
| A |
2 mL乙醇、1 mL乙酸、 1mL18mol·L-1浓硫酸 |
饱和Na2CO3溶液 |
3.0 |
| B |
2 mL乙醇、1 mL乙酸 |
0.1 |
|
| C |
2 mL乙醇、1 mL乙酸、 3 mL 2mol·L-1 H2SO4 |
0.6 |
|
| D |
2 mL乙醇、1 mL乙酸、盐酸 |
0.6 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是3mL和_____mol·L-1。
②分析实验 (填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%。
(1)X的分子式是(写出计算过程) 。
(2)X与金属钠反应放出氢气,反应的化学方程式是 。
(3)X与空气中的氧气在铜或银催化下反应生成Y,Y的结构简式是 。
(4)X与酸性高锰酸钾溶液反应可生成Z,在加热和浓硫酸作用下,X与Z反应可生成一种有香味的物质W。若184 g X和120 g Z反应能生成106 g W,计算该反应的产率(实际产量与理论产量之比) 。
下列关于有机物的说法中,正确的一组是
①“乙醇汽油”是在汽油里加入适量乙醇而成的一种燃料,它是一种新型化合物
②汽油、柴油和植物油都是碳氢化合物,完全燃烧只生成CO2和H2O
③石油的分馏、煤的气化和液化都是物理变化。
④淀粉和纤维素水解的最终产物都是葡萄糖
⑤将ag铜丝灼烧成黑色后趁热插入乙醇中,铜丝变红,再次称量质量等于ag
⑥除去CH4中的少量C2H4,可将混合气体通过盛有溴水的洗气瓶
| A.③⑤⑥ | B.④⑤⑥ | C.①②⑤ | D.②④⑥ |
某校实验室合成环己烯的反应和实验装置(夹持及加热部分已省)如下
相关数据如下:
实验步骤:
1、[合成]:在a中加入20.00g纯环己醇及2小块沸石,冷却搅动下缓慢加入10mL浓硫酸。b中通入冷却水后,缓慢加热a,控制馏出物的温度不超过90℃。
2、[提纯]:将反应后粗产物倒入分液漏斗中,依次用少量5% Na2CO3溶液和水洗涤,分离后加入无水CaCl2颗粒,静置一段时间后弃去CaCl2。再进行蒸馏最终获得12.30g纯环己烯。
回答下列问题:
(1)装置b的名称是_________________。加入沸石的目的是______________ 。
(2)本实验分液所得产物应从 _____________倒出(填“上口”或“下口”)。
(3)提纯过程中加入Na2CO3溶液的目的是_________________
加入无水CaCl2的作用是_________________________________。
(4)本实验所得环己烯的产率是______________________ (产率= ×100%)
×100%)
某化学小组同学欲在实验室中用乙醇制备1,2-二溴乙烷。
甲同学设计的实验装置如下图:
(1)请写出A和B中发生的主要反应的化学方程式:
A中:________________________________________。
B中:________________________________________。
(2)乙同学查阅资料得知:
①此反应可能存在的主要副反应有:在浓硫酸的存在下,乙醇可发生如下反应生成乙醚,
②乙醚不与溴水反应
有关数据列表如下:
| |
乙醇 |
1,2-二溴乙烷 |
乙醚 |
| 颜色、状态 |
无色液体 |
无色液体 |
无色液体 |
| 沸点/℃ |
78.5 |
132 |
34.6 |
若最终产物中混有少量乙醚,可用__________的方法除去。
(3)丙同学观察到:在实验后期A中液体变黑,认为应该在装置A和B之间加入装置__________(填序号),此装置的作用是___________________。