某学习小组探究溴乙烷的消去反应并验证产物。
实验原理:CH3CH2Br + NaOH CH2=CH2↑ + NaBr + H2O
CH2=CH2↑ + NaBr + H2O
实验过程:组装如图1所示装置,检查装置气密性,向烧瓶中注入10mL溴乙烷和15mL饱和氢氧化钠乙醇溶液,微热,观察实验现象。一段时间后,观察到酸性KMnO4溶液颜色褪去。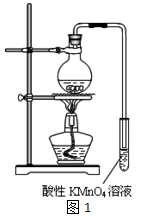
(1)甲同学认为酸性KMnO4溶液颜色褪去说明溴乙烷发生了消去反应,生成了乙烯;而乙同学却认为甲同学的说法不严谨,请说明原因: 。
(2)丙同学认为只要对实验装置进行适当改进,即可避免对乙烯气体检验的干扰,改进方法 。
改进实验装置后,再次进行实验,却又发现小试管中溶液颜色褪色不明显。该小组再次查阅资料,对实验进行进一步的改进。
资料一:溴乙烷于55℃时,在饱和氢氧化钠的乙醇溶液中发生取代反应的产物的百分比为99%,而消去反应产物仅为1%。
资料二:溴乙烷发生消去反应比较适宜的反应温度为90℃~110℃,在该范围,温度越高,产生乙烯的速率越快。
资料三:溴乙烷的沸点:38.2℃。
(3)结合资料一、二可知,丙同学改进实验装置后,溶液颜色褪色不明显的原因可能是 ,此时发生反应的化学方程式为(只写主要发生的反应): 。
(4)结合资料二、三,你认为还应该在实验装置中增加的两种仪器是
① 。
② 。
I.(1)某同学做如下实验,以检验反应中的能量变化。

实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是__________热反应;(b)中温度降低, 根据能量守恒定律,(b)中反应物的总能量应该__________其生成物的总能量。
(2)下列反应:①氢氧化钠与硫酸,②一氧化碳与氧气,③八水合氢氧化钡与氯化铵,④金属铜与硝酸银。其中(用序号填空):能设计成原电池的反应是_________。
II.(1)有下列几种物质
A.金刚石和石墨
B.C2H6和C5H12
C.C2H4和C2H6
D.CH3CH2CH2CH3和CH3CH(CH3)2
E.35Cl和37Cl
属于同分异构体的是_____;属于同素异形体的是_____;属于同系物的是_____;属于同位素的是______。
(2)两种粒子的核外电子排布相同,核电荷数不同,则它们可能是( )
A.两种不同元素的原子 B.一定是两种不同的离子
C.同一元素的原子和离子 D.两种不同元素的原子和离子
III.(1)C7H16名称
(2)指出下列反应的类型:乙烯使酸性高锰酸钾溶液褪色:
(3)写出反应的化学方程式:三氯甲烷与氯气在光照下反应
如图所示的实验装置可用来测定含两种元素的某种气体X的分子式。
在注射器A中装有240毫升气体X并慢慢通过不含空气并装有红热的氧化铜的玻璃管B,使之完全反应,得到以下实验结果:实验前B管重20.32克,实验后B管重20.00克,B管中的黑色粉末变成红色粉末。在C管中收集到的无色液体是水;在注射器D中收集到的气体是氮气。试回答下列问题:
(1)X气体是由________和________元素组成的。
(2)若240毫升X气体完全反应后,收集到的氮气质量是0.28克。根据实验时温度和压强计算1摩尔X气体的体积是24000毫升,则X的摩尔质量是________克/摩尔。
(3)通过计算,确定X的分子式为________。
(4)写出B中发生反应的化学方程式(X在该条件下不发生分解反应)__________________。
某学习小组为探究维生素C的组成和有关性质,进行了以下实验:取维生素C样品研碎,称取该试样0.704 g,置于铂舟并放人燃烧管中,不断通入氧气流。用酒精喷灯持续加热样品,样品逐渐消失最后无任何残留物,将生成物(仅有两种物质)先后通过无水CaCl2和碱石灰,两者分别增重0.288 g和1.056 g,生成物完全被吸收。
请解答下列问题:
(1)称取的试样中,含有氢原子的物质的量是 mo1;碳元素的质最是 g。
(2)维生素C中 (填“含”、“不含”或“无法确定是否”)有氧元素,理由是根据实验数据可知 。如你回答“含”有,请计算称取的试样中氧原子的物质的量并填入下一空格中;如你回答“不含”等,则下一空格不必填写。称取试样中氧原子的物质的量为 mol。
(3)如果要确定维生素C的分子式,你认为还需要知道的信息是 。
某校课外活动小组为了探究铜与稀硝酸反应产生的气体主要是NO而设计了下列实验,装置如图所示(加热装置和固定装置均已略去)。图中K为止水夹(处于关闭状态),F是一半空的注射器。
请回答有关问题:
(1)设计装置A的目的是 ;为达到此目的,应进行的操作是 。
(2)在完成(1)中的“操作”后,将装置B中铜丝插入稀硝酸,并微热之,观察到装置B中的现象是 ;B中反应的离子方程式为: 。
(3)装置E和F的作用是 ;为实现此作用,其操作方法是 。
(4)装置D的作用是 。
(15分)某研究小组为了探究SO2的实验室制法和有关化学性质,设计了如下的实验。
实验I:
(1)实验基本操作分析:
①多孔隔板与活塞相配合,能起到的作用是_____________________________________.
②该实验制H2时需用浓硫酸配制480mL 3 mol/L的稀硫酸,配制中所需的玻璃仪器有250 mL烧杯、l 00mL量筒、玻璃棒、胶头滴管等,还需_______________________.
③该实验过程中H2所起的作用是_____________________________.
(2)实验时先打开活塞,让装置A内试剂反应一段时间后,关闭活塞,再往装置B中滴入适量浓硫酸反应片刻后,甲、乙两学生分别取装置D中少量溶液,甲学生往其中加入酸性KMnO4溶液,观察到酸性KMn O4溶液紫红色褪去;乙学生往其中加入盐酸酸化的BaCl2溶液,观察到有白色沉淀生成。根据各自实验现象甲、乙学生得出SO2被Fe3+氧化。
①试判断甲、乙学生的结论是否严谨________________(填写选项)。
A.甲学生严谨 B.乙学生严谨 C.甲、乙学生都不严谨
②写出SO2被Fe3+氧化的离子反应方程式_____________________________________.
实验II:
(3)该研究小组为测定SO2催化氧化为SO3的转化率,又设计了如下实验:已知SO3熔点为16.8℃,且忽略空气中CO2的影响).
①当停止通入SO2,熄灭酒精灯后,需要继续通入氧气,其目的是:____________________.
②实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是_______________(用含字母的代数式表示,不用化简)。
某兴趣小组依据CO2+2Mg=2MgO+C,推测Mg与SO2在隔绝空气条件下反应后,剩余固体M可能含有MgO、S、MgS、Mg中的一种或几种。为了验证推测,进行以下实验。请回答有关问题。
实验Ⅰ 按下图所示进行实验。
(1)实验前需除去镁条表面氧化膜。用简易的物理方法除氧化膜的操作是 ;
(2)实验室制取二氧化硫的化学方程式为 ;
(3)上述装置存在不合理之处,请提出1项改进建议 ;
(4)实验时,先通入SO2直到 现象出现后,再点燃酒精灯;此操作目的是 。
实验Ⅱ 确定固体M的成分。
实验装置如图所示。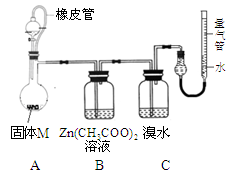
将分液漏斗中稀硫酸(足量)
加入到烧瓶中,完全反应后,实验现象如下:
| 装置 |
A |
B |
C |
量气管 |
| 现象 |
有残留 固体 |
产生白色ZnS沉淀 |
溴水 未褪色 |
进入气体 v mL(标况) |
(5)实验时,B装置中反应的化学方程式为 ;
(6)已知镁的相对原子质量为24,则固体M中金属镁的质量为 g;实验前装置内有空气,对金属镁质量的测定结果的影响是 (填偏低、偏高、无影响);
(7)依以上实验,可确定固体M的成分有 种(填数字)。
某学生探究AgCl、Ag2S沉淀转化的原因。
| 步 骤 |
现 象 |
| Ⅰ.将NaCl与AgNO3溶液混合 |
产生白色沉淀 |
| Ⅱ.向所得固液混合物中加Na2S溶液 |
沉淀变为黑色 |
| Ⅲ.滤出黑色沉淀,加入NaCl溶液 |
较长时间后,沉淀变为乳白色 |
(1)Ⅰ中的白色沉淀是 。
(2)Ⅱ中能说明沉淀变黑的的离子方程式是 ,沉淀转化的主要原因是 。
(3)滤出步骤Ⅲ中乳白色沉淀,推测含有AgCl。用浓HNO3溶解,产生红棕色气体,部分沉淀未溶解,过滤得到滤液X和白色沉淀Y。
ⅰ.向X中滴加Ba(NO3)2溶液,产生白色沉淀
ⅱ.向Y滴加KI溶液,产生黄色沉淀
①由ⅰ判断,滤液X中被检出的离子是 。
②由ⅰ、ⅱ可确认步骤Ⅲ中乳白色沉淀含有AgCl和另一种沉淀______。
(4)该学生通过如下对照实验确认了步骤Ⅲ中乳白色沉淀产生的原因:在NaCl存在下,氧气将Ⅲ中黑色沉淀氧化。
| 现 象 |
B:一段时间后,出现乳白色沉淀 |
| C:一段时间后,无明显变化 |
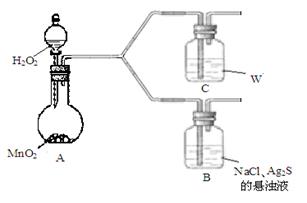
①A中产生的气体是_________。
②C中盛放的物质W是_________。
③该同学认为B中产生沉淀的反应如下(请补充完整):
2Ag2S +  +
+  + 2H2O
+ 2H2O 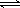 4AgCl +
4AgCl +  + 4NaOH
+ 4NaOH
④B中NaCl的作用是_______。
某同学分析Zn与稀H2SO4的反应。
(1)该反应的离子方程式是 。
(2)制H2时,用稀硫酸而不用浓硫酸,原因是_________。
(3)已知:Zn(s)+1/2O2(g)=ZnO(s) △H=-332kJ/mol
ZnO(s) + H2SO4(aq) = ZnSO4(aq) + H2O(l) △H=-112kJ/mol
H2(g) +1/2 O2(g) = H2O(l) △H=-286kJ/mol
则Zn与稀H2SO4反应生成1mol H2时的反应热△H= kJ/mol。
(4)该同学用如下装置进行实验,分析影响反应速率的因素。
实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1 分钟内从a管流出的水滴数,得到的水滴数如下表所示:
| 1分钟水滴数(断开K) |
34 |
59 |
86 |
117 |
… |
102 |
| 1分钟水滴数(闭合K) |
58 |
81 |
112 |
139 |
… |
78 |
分析反应过程中的水滴数,请回答:
①由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率______(填“快”或“慢”),主要原因是_________。
②由水滴数102>78,说明在反应后期,断开K时的反应速率快于闭合K时的反应速率,主要原因是_______。
③从能量转换形式不同的角度,分析水滴数86>81、117>112的主要原因是_______。
草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
【查阅资料】KMnO4溶液氧化H2C2O4的反应历程为:
【提出假设】
假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是 。
【设计、完成实验】
(1)称取 g草酸晶体(H2C2O4·2H2O),配置500mL0.10mol/L H2C2O4溶液。
①在上述过程中必须用到的2种定量仪器是托盘天平和 。
②下列操作会使所配溶液浓度偏低的是 (填下列选项的字母序号)。
| A.称取草酸晶体时,将草酸晶体放在托盘天平右盘 |
| B.定容时俯视刻度线 |
| C.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水 |
| D.摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容 |
(2)完成探究,记录数据
x = 时,假设2成立。
(3)由于KMnO4能氧化水中有机物等因素,为配制好稳定的KMnO4溶液,其浓度需标定。取10.00 mL 0.10mol/L H2C2O4溶液于锥形瓶中,加入10mL 0.50mol/L稀硫酸,用(2)中KMnO4溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗KMnO4溶液40.00 mL,则草酸溶液与酸性KMnO4溶液反应的离子方程式为 。上述实验中KMnO4溶液的物质的量浓度为 。
某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是_______,其中发生反应的化学方程式___________;
(2)实验过程中,装置B、C中发生的现象分别是_______________、________________,这些现象分别说明SO2具有的性质是_____________和____________;装置B中发生反应的离子方程式为(MnO4-还原为Mn2+)_____________________________。
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象_________________;
(4)尾气可采用________溶液吸收。
(共14分)某同学设计如下实验装置探究硫酸与金属、非金属的反应、验证其产物,并探究随着反应的进行,硫酸性质发生的变化。根据实验要求回答相关问题:
F装置用于检验二氧化碳。供选择的试剂有:只含碳的生铁、18 mol·L-1的硫酸、品红溶液、无水硫酸铜粉未、酸性高锰酸钾溶液、氧化铜、澄清的石灰水、碱石灰。(供选择的试剂可重复使用)
(1)打开分液漏斗的活塞,A装置中发生的反应6H2SO4(浓)+2Fe Fe2(SO4)3+6H2O↑+3SO2↑和 (用化学方程式表示),随反应的进行,硫酸的浓度变稀,又发生反应 (用化学方程式表示)。
Fe2(SO4)3+6H2O↑+3SO2↑和 (用化学方程式表示),随反应的进行,硫酸的浓度变稀,又发生反应 (用化学方程式表示)。
(2)B装置中的试剂是 。
(3)E装置中的作用是 。
(4)G装置中的试剂是 ,现象是 。
(5)从安全角度考虑,应后点燃 的酒精灯(填“A”或“G”)。你认为本实验尾气是否需要处理? (填“是”或“否”),如需处理,具体方案是 。
某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL) |
50 |
120 |
232 |
290 |
310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大 ,原因是 。
(2)哪一段时段的反应速率最小 ,原因是 。
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变,要写出计算过程) 。
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:你认为可行的是(填编号) 。
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol・L-1、2.00 mol・L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为20℃、35℃,每次实验HNO3的用量为25.0 mL、大理石用量为10.00 g。
请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验 编号 |
T/℃ |
大理石 规格 |
HNO3浓度 (mol・L-1) |
实验目的 |
| ① |
25 |
粗颗粒 |
2.00 |
(Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和 探究温度对该反应速率的影响; (Ⅲ)实验①和 探究大理石规格(粗、细)对该反应速率的影响; |
| ② |
|
|
|
|
| ③ |
|
粗颗粒 |
2.00 |
|
| ④ |
25 |
|
|
在生产生活中,金属腐蚀所带来的损失非常严重,所以防止金属腐蚀已经成为科学研究和技术领域的重大问题.兴趣小组的同学在实验室对金属腐蚀进行了探究.
(1)分别在三个洁净干燥的试管中各加一个洁净无锈的铁钉,再在其中两个试管中加入经煮沸迅速冷却的蒸馏水,其它操作请仔细观察图1:____ 号试管中的铁钉最容易生锈.由此可见,铁制品生锈需要的条件是____ _____ .
(2)如图2所示,铁处于A、B、C三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号)____.
(3)据报道,全世界每年因为金属腐蚀造成的直接经济损失约达7000亿美元,我国因金属腐蚀造成的损失占国民生产总值(GNP)的4%.
①钢铁在发生电化学腐蚀时,负极反应为:________ _ .
②请写出用稀硫酸除去铁锈的化学反应方程式为:____ _____ .
③请根据不同的原理,提出防止钢铁腐蚀的两条合理措施:_________ 、 _____ .