北京市朝阳区高三第二次综合练习理综化学试卷
食品添加剂关系到大家健康,下列物质中的添加剂作用不正确的是
| A |
B |
C |
D |
 |
 |
 |
 |
| 防治高血压 |
防治缺铁性贫血 |
做甜味剂 |
做防腐剂 |
下列与处理方法对应的反应方程式不正确的是
| A.工业上用水吸收NO2生产硝酸:3NO2 + H2O = 2HNO3 + NO |
| B.用氨水除去工业原料氯化铵中的氯化铁杂质:Fe3+ + 3OH- = Fe(OH)3↓ |
| C.用熟石灰处理泄漏的液氯:2Ca(OH)2 +2Cl2 = CaCl2 + Ca(ClO)2 +2H2O |
D.用明矾除去水中的悬浮颗粒物:Al3+ + 3H2O  Al(OH)3(胶体) + 3H+ Al(OH)3(胶体) + 3H+ |
下列说法不正确的是
| A.乙二醇用于汽车防冻液 |
| B.麦芽糖在水解前后均能发生银镜反应 |
| C.1-氯丙烷和2-氯丙烷发生消去反应的产物不同 |
D.H2N—CH2—COOH的缩聚产物中含 结构 结构 |
依据下列说法来判断相应元素的金属性、非金属性强弱,不合理的是
| A.卤素单质Cl2、Br2、I2的氧化性强弱 |
| B.气态氢化物NH3、H2O、HF的稳定性 |
| C.碱金属单质Li、Na、K与水反应的剧烈程度 |
| D.1mol Na、Mg、Al分别与足量盐酸反应时失电子数的多少 |
下图为Pt电极的氢氧燃料电池工作原理示意图,H2SO4为电解质溶液。有关说法不正确的是
| A.a极为负极,电子由a极流向b极 |
| B.a极的电极反应式是:H2 -2e- = 2H+ |
| C.电池工作一段时间后,装置中c(H2SO4)增大 |
| D.若将H2改为等物质的量CH4,O2的用量增多 |
用氯气制取并获得碘单质,不能实现实验目的的装置是
| A.用甲制取少量氯气 | B.用乙氧化溶液中的碘离子 |
| C.用丙提取置换出来的碘 | D.用丁过滤I2的CCl4溶液得碘单质 |
根据下列实验及现象,能量关系正确的是
| |
实验及现象 |
能量关系 |
| A |
将“NO2球”置于热水中,红棕色加深 |
N2O4(g) 2NO2(g) △H <0 2NO2(g) △H <0 |
| B |
NaOH与HCl溶液混合,溶液温度升高 |
 |
| C |
钠投入水中,熔化成小球 |
 |
| D |
微热含酚酞的Na2CO3溶液,红色加深 |
CO32-(aq)+H2O(l) HCO3-(aq)+OH-(aq)△H <0 HCO3-(aq)+OH-(aq)△H <0 |
用于合成树脂的四溴双酚F、药物透过性材料高分子化合物PCL合成如下。
(1)W中—R是 。
(2)A的结构简式是_________。
(3)A生成B和CH3COOH的反应类型是_________。
(4)D→X过程中所引入的官能团分别是_________。
(5)E的分子式是C6H10O,E与H2反应可生成X。H的结构简式是________。
(6)有机物Y的苯环上只有2种不同化学环境的氢原子。
①由B生成Y的反应方程式是__________。
②由Y生成四溴双酚F的反应方程式是________。
③在相同条件下,由B转化成四溴双酚F的过程中有副产物生成,该副产物是四溴双酚F的同分异构体,其结构简式可能是 。
(7)高分子化合物PCL的结构简式是________。
某同学分析Zn与稀H2SO4的反应。
(1)该反应的离子方程式是 。
(2)制H2时,用稀硫酸而不用浓硫酸,原因是_________。
(3)已知:Zn(s)+1/2O2(g)=ZnO(s) △H=-332kJ/mol
ZnO(s) + H2SO4(aq) = ZnSO4(aq) + H2O(l) △H=-112kJ/mol
H2(g) +1/2 O2(g) = H2O(l) △H=-286kJ/mol
则Zn与稀H2SO4反应生成1mol H2时的反应热△H= kJ/mol。
(4)该同学用如下装置进行实验,分析影响反应速率的因素。
实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1 分钟内从a管流出的水滴数,得到的水滴数如下表所示:
| 1分钟水滴数(断开K) |
34 |
59 |
86 |
117 |
… |
102 |
| 1分钟水滴数(闭合K) |
58 |
81 |
112 |
139 |
… |
78 |
分析反应过程中的水滴数,请回答:
①由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率______(填“快”或“慢”),主要原因是_________。
②由水滴数102>78,说明在反应后期,断开K时的反应速率快于闭合K时的反应速率,主要原因是_______。
③从能量转换形式不同的角度,分析水滴数86>81、117>112的主要原因是_______。
辉铜矿(主要成分为Cu2S)经火法冶炼,可制得Cu和H2SO4,流程如下图所示:
(1)Cu2S中Cu元素的化合价是 价。
(2)Ⅱ中,电解法精炼粗铜(含少量Ag、Fe),CuSO4溶液做电解质溶液:
①粗铜应与直流电源的 极(填“正”或“负”)相连。
②铜在阴极析出,而铁以离子形式留在电解质溶液里的原因是 。
(3)Ⅲ中,烟气(主要含SO2、CO2)在较高温度经下图所示方法脱除SO2,并制得H2SO4。
①在阴极放电的物质是 。
②在阳极生成SO3的电极反应式是 。
(4)检测烟气中SO2脱除率的步骤如下:
i.将一定量的净化气(不含SO3)通入足量NaOH溶液后,再加入足量溴水。
ii.加入浓盐酸,加热溶液至无色无气泡,再加入足量BaCl2溶液。
iii.过滤、洗涤、干燥,称量沉淀质量。
①用离子方程式表示i中溴水的主要作用 。
②若沉淀的质量越大,说明SO2的脱除率越 (填“高”或“低”)。
某学生探究AgCl、Ag2S沉淀转化的原因。
| 步 骤 |
现 象 |
| Ⅰ.将NaCl与AgNO3溶液混合 |
产生白色沉淀 |
| Ⅱ.向所得固液混合物中加Na2S溶液 |
沉淀变为黑色 |
| Ⅲ.滤出黑色沉淀,加入NaCl溶液 |
较长时间后,沉淀变为乳白色 |
(1)Ⅰ中的白色沉淀是 。
(2)Ⅱ中能说明沉淀变黑的的离子方程式是 ,沉淀转化的主要原因是 。
(3)滤出步骤Ⅲ中乳白色沉淀,推测含有AgCl。用浓HNO3溶解,产生红棕色气体,部分沉淀未溶解,过滤得到滤液X和白色沉淀Y。
ⅰ.向X中滴加Ba(NO3)2溶液,产生白色沉淀
ⅱ.向Y滴加KI溶液,产生黄色沉淀
①由ⅰ判断,滤液X中被检出的离子是 。
②由ⅰ、ⅱ可确认步骤Ⅲ中乳白色沉淀含有AgCl和另一种沉淀______。
(4)该学生通过如下对照实验确认了步骤Ⅲ中乳白色沉淀产生的原因:在NaCl存在下,氧气将Ⅲ中黑色沉淀氧化。
| 现 象 |
B:一段时间后,出现乳白色沉淀 |
| C:一段时间后,无明显变化 |
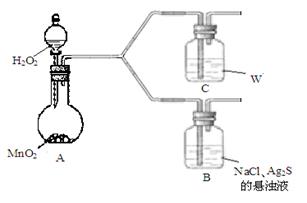
①A中产生的气体是_________。
②C中盛放的物质W是_________。
③该同学认为B中产生沉淀的反应如下(请补充完整):
2Ag2S +  +
+  + 2H2O
+ 2H2O  4AgCl +
4AgCl +  + 4NaOH
+ 4NaOH
④B中NaCl的作用是_______。




 粤公网安备 44130202000953号
粤公网安备 44130202000953号