(11分)三颈瓶在化学实验中的应用非常广泛,下面是三颈瓶在部分无机实验或有机实验中的一些应用。
(1)在如图所示装置中,进行氨的催化氧化实验:向三颈瓶内的浓氨水中不断通入空气,将红热的铂丝插入瓶子并接近液面。反应过程中可观察到瓶中有红棕色气体产生,铂丝始终保持红热。实验过程中 的电离程度____(填“变大”、“变小”或“不变”)
的电离程度____(填“变大”、“变小”或“不变”)
(2)实验室用下图所示装置制备氨基甲酸铵( ),其反应化学方程式:2NH3(g)+CO2(g)
),其反应化学方程式:2NH3(g)+CO2(g)  NH2COONH4(s)该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
NH2COONH4(s)该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
①写出加入药品之前实验操作的要点_______;反应中若有水存在则生成碳酸氢铵的化学方程式是________________________。
②干燥管中盛放的药品是______。简述左侧三颈瓶装置制取氨气的原理________。
③对比碳酸盐和酸的反应制取CO2,该实验利用干冰升华产生气体CO2的有优点有_____.
④有同学认为该实验装置存在安全问题,请问可能面临的安全问题是________。
⑤氨基甲酸氨可用作肥料,其肥效比尿素[CO(NH2)2] _______(填“高”或“低”),在潮湿的空气中释放出氨而变成碳酸氢铵。取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7830g,用足量石灰水充分处理后,使样品中碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g,则样品中氨基甲酸铵的物质的量分数是_____________。
在实验室里可用如图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
上图中:①为氯气发生装置;②的试管里盛有15 mL 30%KOH溶液,并置于水浴中;③的试管里盛有15 mL 8%NaOH溶液,并置于冰水浴中;④的试管里盛有紫色石蕊溶液。
请回答下列问题:
(1)仪器a的名称是_________________。
(2)实验室制取氯气的离子方程式为___________________________________________。
为了除去氯气中的氯化氢气体,可在①与②之间安装盛有_____填字母代号)的净化装置。
| A.碱石灰 | B.饱和食盐水 |
| C.浓硫酸 | D.饱和碳酸氢钠溶液 |
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是________________________。反应完毕经冷却后,②的试管中有大量晶体析出。在图中符合该晶体溶解度曲线的是_____填字母代号);从②的试管中分离出晶体的操作是________,该操作需要用到的玻璃仪器有____________________________。
(4)次氯酸钠中存在的化学键类型为_______________________________。
(5)实验中可观察到④的试管里溶液的颜色发生了如下变化,请完成下表中的空白:
| 实验现象 |
原因 |
| 溶液最初从紫色逐渐变为_________色 |
氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 |
_________________________________________ |
| 然后溶液从无色逐渐变为_________色 |
_________________________________________ |
(6)装置⑤的作用是___________________________。
(18分)Ⅰ.实验室常见的几种气体发生装置如图A、B、C所示:
(1)实验室可以用B或C装置制取氨气,如果用B装置制取氨气其化学反应方程式为 。
(2)气体的性质是选择气体收集方法的主要依据。下列性质与收集方法无关的是______(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
(3)若用A装置与D装置相连制取并收集X气体,则X可以是下列气体中的________。
①CO2 ②NO ③Cl2 ④H2 ⑤HCl
其中在D装置中连接小烧杯的目的是 。
Ⅱ.某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验 。
(4)经测定,样品X中钴、氨和氯的物质的量之比为1∶6∶3 ,钴的化合价为________,制备X的化学方程式为 。
已知:X的化学式类似下列化学式
氢氧化二氨合银:Ag(NH3)2OH 、硫酸四氨合铜:Cu(NH3)4SO4
(5)氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10% NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL cl mol·L-1 的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。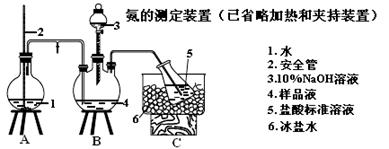
①盛放5(盐酸标准溶液)的仪器名称 。
②装置中安全管的作用原理是 。
③样品中氨的质量分数表达式为 。
某同学设计实验以探究元素性质的递变规律,实验装置如图所示。

实验Ⅰ:根据元素最高价含氧酸的酸性强弱探究元素非金属性递变规律。利用上述装置图1一次性完成Cl、C、Si三种非金属元素的非金属性强弱比较的实验研究
(1)实验中选用的物质名称为:A____________,B__________,C____________;
(2)C处反应的离子方程式为________________。
(3)根据实验现象推知,可得出碳、硅、氯三种元素非金属性的强弱顺序是 。
实验Ⅱ:已知常温下高锰酸钾与浓盐酸混合可产生氯气和Mn2+,利用上述装置图2探究卤族元素性质的递变规律,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。
(4)写出圆底烧瓶中发生反应的离子方程式:_______________________________________。
(5)B处的实验现象为 ______________________________________________。
(6)根据A、B两处的实验现象能否推出非金属性Cl>Br>I, (填“能”或“否”),原因________。
(14分,每空2分)某研究性学习小组设计一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用下图装置完成了O元素的非金属性比S强的实验研究。回答下列问题:
(1)图中D装置在实验中的作用是_______________。
(2)从以下所给物质中选出甲同学设计的实验所用到物质,图中试剂A为_________
①HNO3溶液②稀盐酸③稀醋酸④稀盐酸
写出试管C中发生反应的离子方程式 ______________________________________。
(3)乙同学设计的实验所用到试剂A为_________;试剂B为_________;试剂C为__________。
C处的现象为浅黄色沉淀产生;写出C中发生反应的化学方程式为___________。
某学习小组探究溴乙烷的消去反应并验证产物。
实验原理:CH3CH2Br + NaOH  CH2=CH2↑ + NaBr + H2O
CH2=CH2↑ + NaBr + H2O
实验过程:组装如图所示装置,检查装置气密性,向烧瓶中注入10mL溴乙烷和 15mL饱和氢氧化钠乙醇溶液,微热,观察实验现象。一段时间后,观察到酸性KMnO4溶液颜色褪去。
(1)甲同学认为酸性KMnO4溶液颜色褪去说明溴乙烷发生了消去反应,生成了乙烯;而乙同学却认为甲同学的说法不严谨,请说明原因: 。
(2)丙同学认为只要对实验装置进行适当改进,就可避免对乙烯气体检验的干扰,改进方法为: 。
改进实验装置后,再次进行实验,却又发现小试管中溶液颜色褪色不明显。该小组再次查阅资料,对实验进行进一步的改进。
资料一:溴乙烷于55℃时,在饱和氢氧化钠的乙醇溶液中发生取代反应的产物的百分比为99%,而消去反应产物仅为1%。
资料二:溴乙烷发生消去反应比较适宜的反应温度为90℃~110℃,在该范围,温度越高,产生乙烯的速率越快。
资料三:溴乙烷的沸点:38.2℃。
(3)结合资料一、二可知,丙同学改进实验装置后,溶液颜色褪色不明显的原因可能是 ,此时发生反应的化学方程式为: 。
(4)结合资料二、三,有同学认为应将实验装置中烧瓶改成三颈烧瓶并增加两种仪器,
这两种仪器是① 。② 。
实验室用浓盐酸和MnO2制取并探究Cl2化学性质,装置图下图所示:
(1)A是氯气发生装置,实验室制取Cl2的原理是 (用化学方程式表示)
(2)该实验中A部分的装置是 (填字母)
(3)从C装置出来的气体中含有CO2和HCl,则从B装置导出的气体成分是 。
(4)D装置的作用是 ,可能观察到的现象是 。
(5)为进行有关氯气的性质实验,需要4瓶容积为122 mL的氯气(室温下,氯气的密度为2.91g/L),理论上需要MnO2的质量是 ,实际称量的MnO2固体的质量必须适当多余理论量,原因是
(6)若将装置A如图所示进行连接,探究其与某些溶液分反应的性质,回答下列问题。
①乙装置中FeCl2溶液与Cl2反应的离子方程式是 。证明FeCl2与Cl2发生了氧化还原反应的实验方法是 。
②丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。该物质可能是 。
| A.Cl2 | B.NaClO | C.Na2CO3 | D.Na2O2 |
根据实验目的按要求填空。(a、b为弹簧夹,加热及固定装置已略去)
(1)验证碳、硅非金属性的相对强弱。(已知酸性:亚硫酸>碳酸)
①实验步骤:连接仪器、______ __、加药品后,打开a关闭b,然后滴入浓硫酸,加热。
②铜与浓硫酸反应的化学方程式为___________________,装置A中的试剂是_____ ___。
③能说明碳的非金属性比硅强的实验现象是:__ _____。
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
①实验步骤:打开b,关闭a。
②H2S溶液中有浅黄色浑浊出现,化学方程式为___ _。
③BaCl2溶液中无沉淀现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
| 滴加的溶液 |
氯水 |
氨水 |
| 沉淀的化学式 |
|
|
写出其中SO2 显示还原性并生成沉淀的离子方程式_____ ____。
某同学为了验证碳和硅两种元素非金属性的相对强弱,用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
实验操作步骤:
Ⅰ.打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
Ⅱ.A中看到白色沉淀时,…,关闭活塞a。
请回答:
(1)B中反应的离子方程式是________。
(2)通过步骤Ⅰ得知盐酸具有的性质是________(填字母)。
| A.挥发性 | B.还原性 | C.氧化性 | D.酸性 |
(3)C装置的作用是________,X是________(写化学式)。
(4)为了验证碳的非金属性强于硅,步骤Ⅱ中未写的操作和现象是________,D中反应的化学方程式是________。
(5)碳、硅的非金属性逐渐减弱的原因是________(从原子结构角度加以解释)。
(12分)某化学兴趣小组用下图所示装置进行探究实验,以验证产物 中有乙烯生成且乙烯具有不饱和性。当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色。
(1)写出该实验中生成乙烯使溴水褪色的化学方程式:_______________________。
(2)甲同学认为:考虑到该混合液反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是( )
a.乙烯与溴水易发生取代反应
b.使溴水褪色的反应,未必是加成反应
c.使溴水褪色的物质,未必是乙烯
(3)乙同学经过细致观察后认为试管中液体分层,油状液体在下层的现象可证明反应中有乙烯生成,请你写出下层该物质与NaOH水溶液加热反应的化学方程式 __________________。
(4)丙同学对上述实验装置进行了改进,在Ⅰ和Ⅱ之间增加如图装置,以除去乙烯中的杂质气体,则A中的试剂应为 B中的试剂应为________,气体经过B无现象即可证明是较为纯净的乙烯。
(5)若证明乙烯和溴发生的是加成反应,而不是取代反应,可将产生的气体经净化后通入溴的四氯化碳溶液,再接入如图装置,向 D中加入_________溶液,若无淡黄色沉淀产生,则能证明。
某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.
探究乙酸、碳酸和苯酚的酸性强弱关系该校学生设计了下图的实验装置(夹持仪器已略去).
(1)某生检查装置A的气密性时,先关闭止水夹,从左管向U型管内加水,至左管液面高于右管液面,静置一段时间后,若U型管两侧液面差不发生变化,则气密性良好.你认为该生的操作正确与否?_________ (填“正确”或“错误”)大理石与乙酸溶液反应的化学方程式为 _________
(2)装置A中反应产生的气体通入苯酚钠溶液中,实验现象为 _________ 反应的离子方程式为 _________
(3)有学生认为(2)中的实验现象不足以证明碳酸的酸性比苯酚强,理由是乙酸有挥发性,挥发出的乙酸也可以和苯酚钠溶液反应,生成苯酚.改进该装置的方法是 _________ 证明乙酸为弱酸
(4)现有pH=3的乙酸溶液、蒸馏水、石蕊试液及pH试纸,选用适当的仪器和用品,用最简便的实验方法证明乙酸为弱酸 _______ __
(5)在相同温度下,测定相同物质的量浓度
a.NaHCO3溶液 b.Na2CO3溶液 c.CH3COONa溶液 d. ﹣ONa溶液
﹣ONa溶液
的pH,其pH由大到小排列的顺序为 _________ (填溶液编号)
在生产生活中,金属腐蚀所带来的损失非常严重,所以防止金属腐蚀已经成为科学研究和技术领域的重大问题.兴趣小组的同学在实验室对金属腐蚀进行了探究.
(1)分别在三个洁净干燥的试管中各加一个洁净无锈的铁钉,再在其中两个试管中加入经煮沸迅速冷却的蒸馏水,其它操作请仔细观察图1:_________ 号试管中的铁钉最容易生锈.由此可见,铁制品生锈需要的条件是_________ .
(2)如图2所示,铁处于A、B、C三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号):_________ .
(3)据报道,全世界每年因为金属腐蚀造成的直接经济损失约达7000亿美元,我国因金属腐蚀造成的损失占国民生产总值(GNP)的4%.
①钢铁在发生电化学腐蚀时,负极反应为:_________ .
②请写出用稀硫酸除去铁锈的化学反应方程式为:_________ .
③请根据不同的原理,提出防止钢铁腐蚀的两条合理措施:_________ 、_________ .
为了比较卤素单质的氧化性强弱,可在实验室先制取Cl2,并将Cl2依次通入NaBr溶液和淀粉KI溶液中。有如下图所示的仪器(橡胶塞均为双孔)及药品,试回答:
(1)若所制气体从左向右流向时,上述仪器接口的连接顺序为H接____、___接___、___接___。
(2)装置3的作用是_______________,反应的离子方程式为________________________。
(3)装置1中产生的现象是_________________,反应的化学方程式为_______________。
(4)通过本实验可得到的结论是____________________________________。
某同学探究同周期主族元素性质递变规律时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系):
| 实验步骤 |
实验现象 |
| 1.将镁条用砂纸打磨后,放入沸水中;再向溶液中滴加酚酞溶液 |
A. 浮在水面上,熔成小球,做不定向运动,随之消失,溶液变成红色。 |
| 2.向新制得的Na2S溶液中滴加少量新制的氯水 |
B.有气体产生,溶液变成浅红色 |
| 3.将一小块钠放入滴有酚酞溶液的冷水中 |
C.剧烈反应,迅速产生大量无色气体。 |
| 4.将镁条投入稀盐酸中 |
D.反应不十分剧烈,产生无色气体 |
| 5.将铝条投入稀盐酸中 |
E.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告。
实验目的:探究同周期主族元素性质递变规律。
(1)实验用品:试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液。
仪器:① ,② ,③ ,试管夹,镊子,小刀,玻璃片,砂纸,酒精灯等。
(2)实验内容:(填写与实验步骤对应的实验现象的编号和离子方程式)
| 实验内容 |
实验现象 |
离子方程式 |
| 1 |
|
|
| 2 |
|
|
| 3 |
|
|
| 4 |
|
|
| 5 |
|
|
(3)若用最高价氧化物的水化物的碱性相对强弱来验证Mg、Al失电子能力的强弱,请你设计实验(实验用品自选,不要求写化学方程式): 。
(4)实验结论: ;
某学生做同主族元素性质递变规律的实验时,自己设计了一套实验方案,并记录了有关实验现象。现在请你帮助该学生整理并完成实验报告。
(1)实验目的:探究同一主族元素性质的递变规律。
(2)实验用品:药品:氯水、溴水、溴化钠溶液、碘化钾溶液、四氯化碳。
仪器:①__________;②__________。(请填写两件主要的玻璃仪器)
(3)实验内容:
| 序号 |
实验方案 |
实验现象 |
| ① |
将少量氯水滴入盛有少量NaBr溶液的试管中,振荡;再滴入少量四氯化碳,振荡 |
加入氯水后,溶液由无色变为橙色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为橙红色 |
| ② |
将少量溴水滴入盛有少量KI溶液的试管中,振荡;再滴入少量四氯化碳,振荡 |
加入溴水后,溶液由无色变为黄色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为紫色 |
(4)实验结论:____________________________________。
(5)问题和讨论:①请用结构理论简单说明得出上述结论的原因: 。
②由于F2过于活泼,很难设计一个简单的实验验证其氧化性强弱。试列举两项事实说明F的非金属性比Cl强: ; 。