右图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液。挤压滴管的胶头,下列与试验事实不相符的是
| A.SO2 (NaOH溶液)无色喷泉 | B.NH3(H2O含酚酞)红色喷泉 |
| C.NO(H2O含石蕊)红色喷泉 | D.HCl(AgNO3溶液)白色喷泉 |
下列操作会导致实验结果偏高的是( )
| A.用天平称量20.5g某物质。砝码和药品的位置放反,所得药品的质量。 |
| B.测定Na2CO3溶液的pH时先将pH试纸润湿了再测定,所测得的pH值。 |
| C.配制一定物质的量浓度溶液时,定容时仰视读数,所得溶液的浓度。 |
| D.酸式滴定管在盛装标准溶液前没有用标准溶液润洗,测得的待测液浓度。 |
下列实验可达到实验目的的是:
①将 与NaOH的醇溶液共热制备CH3—CH═CH2
与NaOH的醇溶液共热制备CH3—CH═CH2
② 与适量NaHCO3溶液反应制备
与适量NaHCO3溶液反应制备
③向CH3CH2Br中滴入AgNO3溶液以检验溴元素
④用溴水即可检验CH2=CH-CHO中的碳碳双键
| A.只有① | B.只有①④ | C.只有①③④ | D.都不能 |
用金属铜制取硝酸铜,从节约原料和防止环境污染考虑,最好的方法是
A.Cu Cu(NO3)2 Cu(NO3)2 |
B.Cu Cu(NO3)2 Cu(NO3)2 |
C.Cu CuCl2 CuCl2 Cu(NO3)2 Cu(NO3)2 |
D.Cu CuO CuO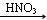 Cu(NO3)2 Cu(NO3)2 |
(12分)实验室有一瓶密封不严的漂白粉,请利用以下仪器和试剂,完成该漂白粉成分的探究。试管、滴管、带导管的单孔塞、蒸馏水、自来水、1mol/LHCl、品红溶液、新制澄清石灰水。
(1) 提出假设:假设一:该漂白粉未变质,含________________________。
假设二:该漂白粉全部变质,含________________________。
假设三:该漂白粉部分变质,含CaCl2 , Ca(ClO)2 ,CaCO3
(2)进行实验:在答题卡上完成下表(不必检验Ca2+、Cl-)
| |
实验步骤 |
预期现象和结论 |
| ① |
用A试管取少量澄清石灰水备用,用B试管取少量样品,再向B试管加入__________ |
若无气体放出且澄清石灰水未见浑浊,则假设________成立: |
| ② |
|
|
| ③ |
|
|
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间(t)产生气体体积(V)的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能是( )
| A.3-4-1-2 | B.1-2-4-3 | C.4-2-3-1 | D.3-4-2-1 |
某研究性学习小组为了探索镁粉与溴水反应的机理,做了如下四组实验:
①将镁粉投入冷水中,未见任何现象;②将镁粉放入溴水中,观察到只是开始时产生极少量的气泡,但溴水的颜色逐渐褪去;③将镁粉放入液溴中,未观察到任何明显现象;④向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去。则下列关于镁与溴水的反应机理的论述中正确的是 ( )
| A.镁粉只直接与溴水中的溴反应 | B.镁粉在水的催化下与溴发生反应 |
| C.产生极少量的气泡是由于镁粉与水反应得到 | D.镁粉只与溴水中的酸反应 |
查阅资料发现,金属钠不仅能与氧气和水反应,还能与很多种其他物质发生反应,其中包括与酒精在常温下反应,要研究金属钠和酒精、金属钠和水反应的异同点,下列的研究方法中用不到的是( )
| A.观察法 | B.分类法 | C.实验法 | D.比较法 |
某校研究性学习小组设计了如下实验步骤来提取碘:
①加H2O2②将海带烧成灰,向灰中加水搅拌③加CC14振荡④过滤⑤用分液漏斗分液。合理的操作顺序为
| A.②→④→①→③→⑤ | B.②→①→③→④→⑤ |
| C.③→①→②→⑤→④ | D.①→③→⑤→②→④ |
下列与实验相关的叙述中,正确的是
A.加热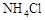 晶体时,将湿润的红色石蕊试纸靠近试管口,检验 晶体时,将湿润的红色石蕊试纸靠近试管口,检验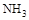 的生成 的生成 |
B.向某溶液中加入足量盐酸酸化,无现象,再加人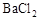 溶液,有白色沉淀生成,说明原溶液中存在 溶液,有白色沉淀生成,说明原溶液中存在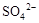 |
| C.酸碱中和滴定实验中用到的玻璃仪器仅有酸式滴定管、碱式滴定管和烧杯 |
D.用量筒量取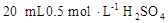 溶液于烧杯中,加水80mL,,配制成0.1 溶液于烧杯中,加水80mL,,配制成0.1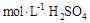 溶液 溶液 |
某兴趣小组对铜与浓硫酸反应产生的黑色沉淀(可能含有CuO、CuS、Cu2S,其中CuS和 Cu2S不溶于稀盐酸、稀硫酸)进行探究,实验步骤如下:
Ⅰ.将光亮铜丝插人浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为 .
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是 .
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
| 装置 |
现象 |
结论及解释 |
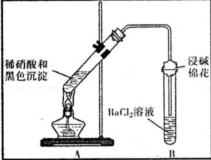 |
①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 |
a.现象②说明褐色沉淀具有 性. b.试管B中产生白色沉淀的总反应的离子方程式为 |
(4)CuS固体能溶于热的浓硫酸,请用有关平衡移动原理加以解释: .
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4﹣+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4﹣+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2溶液反应完全.则混合物中Cu2S 的质量分数为 .
某校化学研究性学习小组设计如下实验方案,测定放置已久的小苏打样品中纯碱的质量分数。
(1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。实验中加热至恒重的目的是 。
(2)方案二:按下图装置进行实验。并回答以下问题:
①实验前应先________________。分液漏斗中应该装___________(填“盐酸”或“稀硫酸盐”)。D装置的作用是_________________________________________;
②实验中除称量样品质量外,还需称________装置(用字母表示)前后质量的变化;
③根据此实验得到的数据,测定结果有较大误差。因为实验装置还存在一个明显缺陷,该缺陷是 。
(3)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液,过滤洗涤,干燥沉淀,称量固体质量,计算:
①过滤操作中,除了烧杯、漏斗外还用到的玻璃仪器有______________________;
②试验中判断沉淀是否完全的方法是_______________________________________
③若加入试剂改为氢氧化钡,已知称得样品9.5g,干燥的沉淀质量为19.7g,则样品中碳酸钠的质量分数为_________________(保留一位小数)。
某探究小组用洗净的废铜屑制备硝酸铜,下列方案中既节约原料又环保的是
| A.Cu+HNO3(浓)→Cu(NO3)2 |
| B.Cu+HNO3(稀)→Cu(NO3)2 |
C.Cu CuO CuO Cu(NO3)2 Cu(NO3)2 |
D.Cu  CuSO4 CuSO4 Cu(NO3)2 Cu(NO3)2 |
下列实验操作都可能引起实验误差,其中说法正确的是( )
| A.常温下测定的气体摩尔体积大于22.4 L·mol-1 |
| B.100 mL 0.1 mol·L-1NaOH溶液和100 mL 0.1mol·L-1CH3COOH溶液反应放出的热量等于573 J |
| C.配制1.0 mol·L-1NaCl溶液定容时仰视容量瓶的刻度线导致所配溶液浓度偏高 |
| D.中和滴定时,锥形瓶含有水就注入待测液,所测待测液浓度减小 |
某研究性学习小组为了制取氨气和探究氨气的有关性质,进行了下列实验。
(1)根据图A氨气的制备装置制取氨气,试回答:收集氨气的方法是________________:装置中棉花的作用是_______________。
(2)甲、乙两组同学用干燥的圆底烧瓶各收集一瓶氨气,根据图B喷泉实验的装置进行实验,都观察到美丽的红色喷泉。
根据实验现象说明氨气具有的性质是____________________________________。
(3)甲、乙两组同学完成喷泉实验后,圆底烧瓶中所得溶液如图C所示。请通过分析确认:甲组同学所得氨水的物质的量浓度_______(填“大于”、“小于”或“等于”)乙组同学所得氨水的物质的量浓度。