某些资料认为:NO、NO2不能与Na2O2反应。某小组学生提出质疑,他们从理论上分析过氧化钠和二氧化氮都有氧化性,根据化合价升降原则提出假设: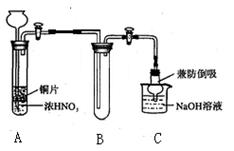
假设Ⅰ.过氧化钠氧化二氧化氮
假设Ⅱ.二氧化氮氧化过氧化钠
(1)小组甲同学设计实验如下:
①试管A中反应的化学方程式是 。
②待试管B中收集满气体,向试管B中加入适量 Na2O2粉末,塞紧塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将余烬木条迅速伸进试管内,看见木条复燃。甲同学认为假设Ⅱ正确;乙同学认为该装置不能达到实验目的,为达到实验目的,在A、B之间增加一个装置,该装置的作用是 。
③乙同学用改进后装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;余烬木条未复燃。得出结论:假设Ⅰ正确。NO2和Na2O2反应的方程式是 。
(2)丙同学认为NO易与O2发生反应,应更易被Na2O2氧化。
查阅资料:① 2NO+Na2O2=2NaNO2
②6NaNO2+3H2SO4=3Na2 SO4+ 2HNO3+4NO↑+2H2O;
③酸性条件下,NO或NO2–都能与MnO4–反应生成NO3–和Mn2+
丙同学用下图所示装置(部分夹持装置略)探究NO与Na2O2的反应。
①B中观察到的主要现象是 ,F装置的作用是 。
②在反应前,打开弹簧夹,通入一段时间N2,目的是 。
③充分反应后,检验D装置中发生反应的实验是 。
某同学对Cl2与KI溶液的反应进行了实验探究。反应装置如下:
通入氯气一段时间,KI溶液变为黄色。继续通入氯气一段时间后,溶液黄色褪去,变为无色。继续通入氯气,最后溶液变为浅黄绿色。
(1)已知I2+I- I3- ,I2、I3-在水中均呈黄色。为确定黄色溶液的成分,进行了以下实验。
I3- ,I2、I3-在水中均呈黄色。为确定黄色溶液的成分,进行了以下实验。
| |
操作 |
实验现象 |
| a |
取2~3 mL黄色溶液,加入足量CCl4, 振荡静置。 |
CCl4层呈紫红色, 水层显浅黄色。 |
| b |
取2~3 mL饱和碘水,加入足量CCl4, 振荡静置。 |
CCl4层呈紫红色,水层几近无色。 |
① 实验b的目的是 。
② 根据实验a中,水层中含有的粒子有 。
③ 实验a中水溶液颜色变浅的原因是 。
④ 为保证实验的严谨性,在实验a、b的基础上,需补充一个实验,该实验为 。
(2)通入氯气,溶液由黄色变为无色,是因为氯气将I2氧化。已知1 mol Cl2可氧化0.2 mol I2,该反应的化学方程式是 。
(3) 根据上述实验,请预测向淀粉-KI溶液中持续通入氯气,可能观察到的现象为 。
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验:
实验一 配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol·L-1的醋酸溶液,用0.2 mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
(1)配制250 mL 0.2 mol·L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、________和________。
(2)为标定某醋酸溶液的准确浓度,用0.2000 mol·L-1的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 |
1 |
2 |
3 |
4 |
| 消耗NaOH溶液的体积(mL) |
20.05 |
20.00 |
18.80 |
19.95 |
则该醋酸溶液的准确浓度为________。(保留小数点后四位)
实验二 探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,结果如下:
| 醋酸浓度(mol·L-1) |
0.0010 |
0.0100 |
0.0200 |
0.1000 |
0.2000 |
| pH |
3.88 |
3.38 |
3.23 |
2.88 |
2.73 |
回答下列问题:
(1)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是:____________________。
(2)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度将________。(填“增大”“减小”或“不变”)
实验三 探究温度对醋酸电离程度的影响
请你设计一个实验完成该探究,请简述你的实验方案:____________。
某小组同学将一定浓度NaHCO3溶液加入到CuSO4溶液中发现生成了沉淀。甲同学认为沉淀是CuCO3;乙同学认为沉淀是CuCO3和Cu(OH)2的混合物,他们设计实验测定沉淀中CuCO3的质量分数。
(1)按照甲同学的观点,发生反应的离子方程式为 。
(2)两同学利用下图所示装置进行测定:
①在研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为过滤、洗涤、干燥。
②装置E中碱石灰的作用是 。
③实验过程中有以下操作步骤:
a.关闭K1、K3,打开K2、K4,充分反应
b.打开K1、K4,关闭K2、K3,通入过量空气
c.打开K1、K3,关闭K2、K4,通入过量空气
正确的顺序是 (填选项序号,下同)。若未进行步骤 ,将使测量结果偏低。
④若沉淀样品质量为m g,装置D质量增加了n g,则沉淀中CuCO3的质量分数为 。
(3)丙同学认为还可以通过测量CO2的体积并测量 来测定沉淀中CuCO3的质量分数。
某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验。
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是__________________,其中发生反应的化学方程式为______________;
(2)实验过程中,装置B、C中产生的现象分别是___________、___________,这些现象分别说明SO2具有的性质是___________和___________;装置B中发生反应的离子方程式为_________________________________________________。
(3)装置D的目的是探究SO2与品红溶液作用的可逆性,请写出实验操作及现象____________;
(4)尾气可采用______________溶液吸收。
某研究性学习小组的一个课题是“NO2能否支持木条的燃烧?”由于实验室中没有现成的NO2气体,该小组的同学设计了两个方案(忽略N2O4的存在,图中铁架台等夹持仪器均已略去):
I.实验装置如下图所示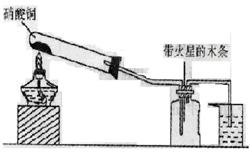
(1)硝酸铜固体加热分解的产物有氧化铜、二氧化氮和氧气。写出该反应的化学方程________________。
(2)当集气瓶中充满红棕色气体时,木条复燃了。有的同学得出“NO2能支持木条的燃烧”的结论。你认为这一结论是否正确?____________(填“正确”或“不正确”),理由是_______
II.实验装置如图所示:
(1)写出浓硝酸受热分解的化学方程式:__________________________________。
(2)实验开始后木条上的火星逐渐熄灭,有的同学提出“NO2不能支持 木条的燃烧”的结论。你认为这一结论是否正确?________(填“正确”或“不正确”),理由是 。
III.为了更能直接说明“NO2能否支持木条的燃烧”这一问题,请你重新设计一个简单的实验方案,简述实验原理和主要操作。_________________________________________________。
根据Mg能在CO2中燃烧,某兴趣小组推测Na应该也能在CO2中燃烧,且固体产物可能为C、Na2O和Na2CO3中的两种或三种。该小组用如下图装置进行了实验探究。已知PdCl2能被CO还原得到黑色的Pd。
回答下列问题:
(1)为了使反应随开随用,随关随停,上图虚线方框内应选用 装置(填下图字母代号),如何检验所选装置的气密性 。
(2)装置2中所盛试剂为 。
A.NaOH溶液 B.饱和NaHCO3溶液
C.饱和Na2CO3溶液 D.饱和NaCl溶液
(3)检测装置的气密性完好并装好药品后,在点燃酒精灯前应先进行装置1中的反应操作,待观察到 现象时,再点燃酒精灯,这步操作的目的是 。
(4)由实验现象和进一步的探究得出反应机理。
A.装置6中有黑色沉淀生成;
B.取反应后直玻管中的固体物质23.0g溶于足量的水中,无气泡产生且得到澄清的溶液;将溶液加水稀释配成250 mL的溶液;
C.取25.00ml步骤B的溶液,滴加足量BaCl2溶液,将生成的白色沉淀过滤、洗涤、干燥,称量得固体质量为1.97g。
①步骤C中不溶物干燥前必须经过洗涤,如何检验该沉淀是否洗涤干净 。
②该探究得出钠与二氧化碳反应的化学方程式为 。
某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。
可选药品:稀硝酸、浓硝酸、浓硫酸、NaOH溶液、蒸馏水
查阅资料:
A.浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。
B.氢氧化钠溶液不与NO反应,能与NO2反应2NO2 + 2NaOH = NaNO3 + NaNO2 +H2O
| 实验过程 |
实验现象 |
| I.检验装置的气密性 |
|
| II.…… |
|
| III.打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞。 |
①中产生大量的红棕色气体,红棕色气体在②中变为无色,气体通过③后依然为无色,通过④后变为红棕色 |
(1)①中发生反应的离子方程式是 。
(2)②中发生反应的化学方程式是 。
(3)装置②~⑤中盛放的药品分别是② 、③ 、④ 、⑤ 。
(4)II的操作是 ,目的是 。
(5)该同学得出结论所依据的实验现象是 。
某化学课外活动小组通过实验研究NO2的性质.
已知:2NO2+2NaOH═NaNO3+NaNO2+H2O
利用图1所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置略去)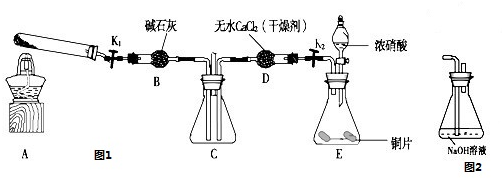
(1)E装置中制取NO2反应的离子方程式是
(2)该实验中制取氨气时若只用一种试剂,从下列物质中选取 ( )
a.NH4HCO3 b.NH4Cl c.浓氨水
(3)若NO2能够被NH3还原,预期观察到C装置中的现象是
(4)此实验装置存在一个明显的缺陷是
(5)探究NO2能否与Na2O2发生氧化还原反应.为了验证NO2能被Na2O2氧化,该小组同学选用B、D、E装置,将B中的药品更换为Na2O2,另选F装置(如图2所示),重新组装,进行实验.装置的合理连接顺序是
(6)实验过程中,B装置中淡黄色粉末逐 渐变成白色.经检验,该白色物质为纯净物,且无其他物质生成.推测B装置中反应的化学方程式为
某氯化亚铁和氯化铁的混合物。现要测定其中铁元素的质量分数,按以下步骤
进行实验:
Ⅰ.请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、胶头滴管、玻璃棒外,还必须有 。(填仪器名称)
(2)请写出加入氯水发生的离子反应方程式 。
(3)将沉淀物加热、灼烧,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2=0.3g,则接下来还应进行的操作是
;蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量分数是 。
Ⅱ.有同学提出,还可以采用以下方法来测定:
(1)选择的还原剂是否能用铁 (填“是”或“否”),原因是: ;
(2)若滴定用掉c mol•L-1 KMnO4溶液b mL,则样品中铁元素的质量分数是: 。
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用右图所示装置进行有关实验。
请回答:
(1) 装置A中发生的化学反应方程式为
_____________________________________。
(2) 装置D中试管口放置的棉花中应浸一种液体,这种液体是 ,其作用是 。
(3) 装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是 。
B中应放置的液体是(填字母) 。
a.水 b.酸性KMnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
(4) 实验中,取一定质量的铜片和一定体积18 mol·L—1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
① 有一定量的余酸但未能使铜片完全溶解,你认为原因是 。
② 下列药品中能用来证明反应结束后的烧瓶中确有余酸的是________(填字母)。
a.NaOH固体 b.BaCl2溶液 c.银粉 d.Na2CO3溶液
某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为沉淀可能是CuCO3;乙同学认为沉淀可能是Cu(OH)2;
丙同学认为沉淀可能是CuCO3和Cu(OH)2的混合物。(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
Ⅰ、⑴按照甲同学的观点,发生反应的离子反应方程式为______________________;
(2)在探究沉淀成分前,须将沉淀从溶液中过滤、洗涤、低温干燥,检验沉淀是否洗涤干净的方法是 。
Ⅱ、请用下图所示装置,选择必要的试剂,定性探究生成物的成分。
(1)各装置连接顺序为_________→_________→___________。
(2)能证明生成物中有CuCO3的实验现象是_____________________________________。
Ⅲ、若CuCO3和Cu(OH)2两者都有,可利用下列装置通过实验测定其组成。
(1)装置C中碱石灰的作用是_________________________________________。
(2)若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为__________。
(13分)某校化学兴趣小组为探究铁与浓硫酸的反应,设计了图1、图2所示装置进行实验。
(1)比较两个实验装置,图2装置的优点是:
①能更好的吸收有毒气体SO2防止其污染环境;
② 。
(2)导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到”液封”作用阻止SO2气体逸出而防止污染环境;二是 。
(3)能说明有SO2气体产生的实验现象是 。
(4)反应一段时间后,用滴管吸取A试管中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:
Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+。
为验证Ⅱ、Ⅲ的可能性,选用如下试剂,填写下列空格:
| A.稀HCl溶液 | B.稀硫酸 | C.KSCN溶液 | D.酸性KMnO4溶液 |
E.NaOH溶液 F.淀粉KI溶液 G. H2O2溶液
验证Ⅱ:取试样,先滴加少量的 (填试剂序号,下同),振荡,再滴加少量的 ,根据溶液颜色的变化可确定假设Ⅱ是否正确。
验证Ⅲ:步骤1.取试样,滴加少量的 (填试剂序号),溶液的颜色变 色,则试样中含有Fe3+发生反应的离子方程式为 。
步骤2.再取适量的试样滴加少量的 (填试剂序号),溶液颜色的变化为 ,则试样中含有Fe2+。
硫酸铜受热分解生成氧化铜和气体,受热温度不同,该气体成分也不同。气体成分可能含SO2、SO3和O2中的一种、二种或三种。某化学课外活动小组通过设计一探究性实验,测定反应产生的SO2、SO3和O2的物质的量,并经计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式,实验用到的仪器如下图所示:
 |
【提出猜想】
I.所得气体的成分可能只含_________一种;
II.所得气体的成分可能含有__________二种;
III.所得气体的成分可能含有SO2、SO3、O2三种。
【实验探究】
实验操作过程(略)。已知实验结束时,硫酸铜完全分解。
请回答下列问题:
(1)请你组装探究实验的装置,按从左至右的方向,行仪器接口连接顺序为__________(填序号);
(2)若实验结束,B中量筒没有收集到水,则证明猜想__________正确;
(3)实验过程,仪器C的作用是 ________________________;
(4)有两个实验小组进行该实验,由于加热时的温度不同,实验结束后测得相关数据也不同,数据如下:
请通过计算,推断出第①小组和第②小组的实验条件下CuSO4分解的化学反应方程式:
① 组_________________________________________________________________;
② 组_______________________________________________________________。
某研究小组探究SO2和Fe(NO3)3溶液的反应。
已知:1.0 mol/L的Fe(NO3)3溶液的pH=l
请回答:
(1)装置A中反应的化学方程式是____________。
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是___________。
(3)装置B中产生了白色沉淀,其成分是____________,说明SO2具有________性。
(4)分析B中产生白色沉淀的原因:
观点1.____________;
观点2:SO2与Fe3+反应;
观点3:在酸性条件下SO2与NO3-反应;
①按观点2,装置B中反应的离子方程式是___________,为证明该观点应进一步检验生成的新物质,其实验操作及现象是__________。
②按观点3,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验。应选择的试剂是(填序号)____________。
a.0.1 mol/L稀硝酸
b.1.5 mol/L Fe(NO3)2溶液
c.6.0 mol/L NaNO3和0.2 mol/L盐酸等体积混合的溶液