钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe+2H2O+O2 2Fe(OH)2。以下说法正确的是( )
| A.负极发生的反应为:Fe-2e- |
| B.正极O2被氧化发生氧化反应 |
| C.原电池是将电能转变为化学能的装置 |
| D.钢柱在水下部分比在空气与水交界处更容易腐蚀 |
钢铁在腐蚀过程中,下列变化可能发生的是( )
①铁元素由+2价转化为+3价
②氧气被还原
③产生氢气
④Fe(OH)3失水生成Fe2O3·xH2O
⑤杂质碳被氧化而除去
| A.①② | B.③④ | C.①②③④ | D.①②③④⑤ |
下列有关钢铁腐蚀说法正确的是
| A.钢铁腐蚀时铁作正极 |
| B.钢铁腐蚀时铁发生的反应为:Fe-3e - = Fe3+ |
| C.在碱性环境中正极反应式为:O2+2H2O +4e-=4OH- |
| D.在酸性环境中正极反应式为:O2+4H++4e-=2H2O |
钢铁在潮湿环境中发生电化学腐蚀时,正极所发生的主要反应是( )
| A.Fe-2e-=Fe2+ |
| B.2H++2e-=H2↑ |
| C.2H2O+O2+4e-=4OH- |
| D.4OH--4e-=2H2O+O2↑ |
“暖宝宝”取暖片的材料中含有铁粉、水、硅石、食盐、等,它们组成一个原电池,在反应时释放出热量,铁粉在原电池中充当
| A.负极 | B.正极 | C.阴极 | D.阳极 |
下列有关金属腐蚀与防护的说法正确的是
| A.纯银器表面在空气中主要因电化学腐蚀渐渐变暗 |
| B.当镀锡铁制品的镀层破损时,镶层仍能对铁制品起保护作用 |
| C.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
| D.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
下列化学实验事实及解释都正确的是
| A.向Na2S03溶液中加入硝酸酸化的BaCl2溶液,有白色沉淀出现,说明Na2S03溶液已经变质 |
| B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
C.等体积、 都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性: 都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性: |
D.向浓度均为0.1 的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成Cu(OH)2沉淀,说明 的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成Cu(OH)2沉淀,说明 |
糕点(如月饼)包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是
| A.脱氧过程是吸热反应,可降低温度,延长糕点保质期 |
| B.脱氧过程中铁作原电池正极,电极反应为:Fe—3e— =Fe3+ |
| C.脱氧过程中碳做原电池负极,电极反应为:2H2O + O2 + 4e—= 4OH— |
| D.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |
下图可设计成多种用途的电化学装置。下列分析正确的是
| A.当a和b用导线连接时,溶液中的SO42-向铜片附近移动 |
| B.将a与电源正极相连可以保护锌片,这叫牺牲阳极的阴极保护法 |
| C.当a和b用导线连接时,铜片上发生的反应为:2H++2e →H2↑ |
| D.a和b用导线连接后,电路中通过0.02mol电子时,产生0.02mol气体 |
关于金属腐蚀和防护的说法不正确的是
| A.金属腐蚀过程中发生了化学反应 |
| B.在铁表面镀锌可对铁起保护作用 |
| C.在铁船壳上镶嵌铜块能减缓船体的腐蚀 |
| D.铝制品在空气中不易被腐蚀,是因其表面形成了致密的氧化铝保护层 |
下列说法正确的是
| A.用上图所示方法可保护钢闸门不被腐蚀 |
| B.SiO2(s)+2C(s)=Si(s)+2CO(g)在常温下不能自发进行,则该反应的△H>0 |
C.常温下,NH4Cl溶液加水稀释, 增大 增大 |
D.C(s)+H2O(g) CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动 CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动 |
下列说法正确的是
| A.用上图所示方法可保护钢闸门不被腐蚀 |
| B.SiO2(s)+2C(s)=Si(s)+2CO(g)在常温下不能自发进行,则该反应的△H>0 |
C.常温下,NH4Cl溶液加水稀释,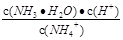 增大 增大 |
D.C(s)+H2O(g) CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动 CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动 |