下列叙述的方法不正确的是 ( )
| A.金属的电化学腐蚀比化学腐蚀更普遍 | B.用铝质铆钉铆接铁板,铁板易被腐蚀 |
| C.钢铁在干燥空气中不易被腐蚀 | D.用牺牲锌块的方法来保护船身 |
钢铁常常发生两种电化学腐蚀时,下列分析正确的是
| A.负极发生的反应相同 | B.正极发生的反应相同 |
| C.酸性水膜中,正极吸收氧气反应 | D.中性水膜时,氧气发生氧化反应 |
下列说法不正确的是
| A.质谱和核磁共振不仅可用于有机小分子结构的分析,还可用于蛋白质结构的研究 |
| B.储氢金属吸氢形成金属氢化物,改变条件释放吸收的氢气,是氢气贮存的重要途径 |
| C.牺牲阳极的阴极保护法、外加电源的阳极保护法和改变金属组成或结构的方法都是防止金属腐蚀的方法 |
| D.乙醇与水互溶,这与乙醇和水分子之间能形成氢键有关 |
化学与生产、生活密切相关。下列叙述正确的是
| A.使用含有氯化钠的融雪剂会加快桥梁的腐蚀 |
| B.“海水淡化”可以解决“淡水供应危机”,向海水中加入净水机明矾可以使海水淡化 |
| C.煤经过气化、液化等物理变化可得到清洁燃料 |
| D.棉花、羊毛、木材和草类的主要成分都是纤维素 |
钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe+2H2O+O2 = 2Fe2++4OH-。以下说法正确的是
| A.负极发生的反应为:Fe-2e-= Fe2+ |
| B.正极发生的反应为:2H2O+O2+2e-= 4OH- |
| C.原电池是将电能转变为化学能的装置 |
| D.钢柱在水下部分比在空气与水交界处更容易腐蚀 |
下列与金属腐蚀有关的说法正确的是( ) 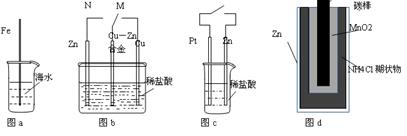
| A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重 |
| B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小 |
| C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
| D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
下列与金属腐蚀有关的说法正确的是
| A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重 |
| B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小 |
| C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
| D.图d中,Zn-MnO2干电池腐蚀漏液主要是由MnO2的氧化作用引起的 |
利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置来,
如废铝罐和碳棒,食盐水等材料制作可用于驱动玩具的电池。上述电池工作时,有关说法正确的是
| A.铝罐将逐渐被腐蚀 |
| B.碳棒上发生的反应为:O2+4e-===2O2- |
| C.碳棒应与玩具电机的负极相连 |
| D.该电池工作一段时间后碳棒的质量会减轻 |
下列有关金属腐蚀与防护的说法正确的是
| A.钢柱在水下部分比在空气与水交界处更容易腐蚀 |
| B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
| D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面图。
下列说法正确的是
| A.该电化腐蚀为析氢腐蚀 |
| B.图中生成铁锈最多的是C区域 |
| C.A区域比B区域更易腐蚀 |
| D.铁闸中的负极的电极反应:Fe-2e-= Fe2+ |
下图烧杯中盛有稀硫酸,则:
(1)A中进行的离子反应方程式为 。
(2)B中各电极的电极反应式:负极: ;正极: 。
(3)C中被腐蚀的金属是 ,正极反应 。
(4)三烧杯中铁被腐蚀的速率由快到慢的顺序是 。
下列有关说法正确的是
| A.白铁(镀锌铁皮)镀层破损后铁仍不易腐蚀 |
B.CH3Cl(g)+Cl2(g) CH2Cl2(l)+HCl(g)能自发进行,则该反应的ΔH>0 CH2Cl2(l)+HCl(g)能自发进行,则该反应的ΔH>0 |
| C.MnS悬浊液中滴加少量CuSO4溶液可生成CuS沉淀,则Ksp(CuS)< Ksp(MnS) |
| D.合成氨生产中将NH3液化分离,一定能加快正反应速率,提高H2的转化率 |