Ⅰ、铁及其化合物与生产、生活关系密切。
(1)右图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
①该电化腐蚀称为_____________,
②图中A、B、C、D、四个区域,生成铁锈最多的是__________(填字母).
(2)已知:Fe(s)+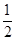 O2(g)═FeO(s)△H=-272kJ•mol-1
O2(g)═FeO(s)△H=-272kJ•mol-1
C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1
则高炉炼铁过程中FeO(s)+CO(g)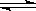 Fe(s)+CO2(g)△H=__________。
Fe(s)+CO2(g)△H=__________。
Ⅱ、甲醇是一种重要的化工原料和新型燃料。下图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极.工作一段时间后,断开K,此时A、B两极上产生的气体体积相同.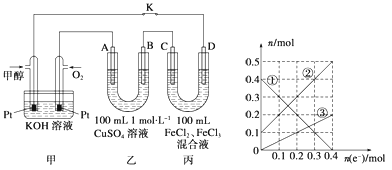
(1)甲中负极的电极反应式为__________。
(2)乙中A极析出的气体在标准状况下的体积为__________。
(3)丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图3,则图中②线表示的是__________的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要__________mL 5.0mol•L-1 NaOH溶液。
下列叙述正确的是
| A.电解饱和食盐水时,用铁作阳极,Cl- 发生氧化反应 |
| B.铅蓄电池放电时,负极质量减轻,正极质量增加 |
| C.马口铁(镀锡铁)镀层破损后即失去保护作用 |
| D.钢铁发生电化学腐蚀的负极反应式:Fe-3e- ="=" Fe3+ |
下列事实不能用电化学原理解释的是( )
| A.常温条件下,在空气中铝不容易被腐蚀 |
| B.镀锌铁片比镀锡铁片更耐腐蚀 |
| C.用锌与硫酸制氢气时,往硫酸中滴少量硫酸铜 |
| D.远洋海轮的尾部装上一定数量的锌板 |
钢铁发生吸氧腐蚀时,正极上发生的电极反应是
| A.2H++2e—=H2 | B.Fe2++2e—=Fe |
| C.Fe-2e—=Fe2+ | D.O2+2H2O+4e—=4OH— |
钢铁在潮湿的空气中会形成原电池而被腐蚀,下列说法正确的是 ( )
A.原电池的正极反应为:O2+2H2O+ 4e-→4OH- 4e-→4OH- |
| B.原电池的负极反应为:Fe→Fe3++3e- |
| C.钢铁设备上连接铜块可以防止腐蚀 |
| D.钢铁与外加直流电源的正极相连可以防止腐蚀 |
下列说法正确的是
| A.金属腐蚀就是金属原子失去电子被还原的过程 |
| B.合金都比纯金属易被腐蚀 |
| C.将金属与外加直流电源的负极相连,而将正极接到废铁上,可以防止金属被腐蚀 |
| D.钢铁设备上连接铜块可以防止钢铁被腐蚀 |
下列说法正确的是
| A.金属腐蚀就是金属原子失去电子被还原的过程 |
| B.镀锌铁皮的镀层损坏后,铁还是受到保护而难以腐蚀 |
| C.钢铁的腐蚀通常有吸氧腐蚀和析氢腐蚀,通常情况下以吸氧腐蚀为主 |
D.氯碱工业中,阳极发生的反应为: |
据环保部门测定,我国一些大城市的酸雨pH=3.5。在酸雨季节铁制品极易腐蚀,则在其腐蚀中正极发生的反应是 ( )
| A.2H+ + 2e— = H2↑ | B.2H2O + O2 + 4e— = 4OH— |
| C.Fe-2e— = Fe2+ | D.4OH—-4e— = 2H2O + O2↑ |
金属腐蚀造成的损失非常严重,金属腐蚀可分为化学腐蚀和电化学腐蚀。下列现象不能用电化学腐蚀来解释的是
| A.铜板上的铁铆钉在阴雨天易生锈 |
| B.马口铁(镀锡的铁)破损后很快生锈 |
| C.铜器皿在高温环境中迅速变黑 |
| D.电工作业中若将铜、铝导线直接相连易出现接触不良现象 |
下列有关金属腐蚀与防护的说法不正确的是
| A.纯银器表面在空气中因化学腐蚀渐渐变暗 |
| B.当镀锌铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
| D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
下列说法不正确的是
A.钢铁的吸氧腐蚀和析氢腐蚀的负极反应均为 |
B.钢铁发生吸氧腐蚀,正极的电极反应为: |
| C.破损后的镀锌铁板比镀锡铁板更耐腐蚀 |
| D.用牺牲阳极的阴极保护法保护钢铁,牺牲阳极作原电池的正极 |
下列关于实验现象的描述不正确的是 ( )
| A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 |
| B.用锌片作负极,铁片作正极,稀硫酸为电解质溶液一段时间后,溶液PH增大 |
| C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁 |
| D.铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓海轮腐蚀 |