如图装置中, a、b试管内分别盛有食盐水和氯化铵溶液,各加入一块生铁片,放置一段时间。下列有关描述错误的是
| A.红墨水柱两边的液面变为左低右高 |
| B.两块生铁片均发生电化学腐蚀 |
| C.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀 |
| D.两试管中相同的电极反应式为Fe → Fe2+ + 2e- |
下列说法不正确的是
A.钢铁的吸氧腐蚀和析氢腐蚀的负极反应均为 |
B.钢铁发生吸氧腐蚀,正极的电极反应为: |
| C.破损后的镀锌铁板比镀锡铁板更耐腐蚀 |
| D.用牺牲阳极的阴极保护法保护钢铁,牺牲阳极作原电池的正极 |
下列事实中,与电化学腐蚀无关的是( )
| A.埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀。 |
| B.在空气中,金属银的表面生成一层黑色物质 |
| C.为保护海轮的船壳,常在船壳上镶入锌块。 |
| D.镀银的铁质品,镀层部分受损后,露出的铁表面更易被腐蚀。 |
2008年10月8日,瑞典皇家科学院宣布美籍华裔科学家钱永健获得2008年度诺贝尔化学奖.少年时代,他就对化学产生了浓厚的兴趣。16岁时,他凭借一个金属易受硫氰酸盐腐蚀的调查项目,荣获具有“少年诺贝尔奖”之称的著名奖项。下列说法正确的是
| A.金属腐蚀就是金属失去电子被还原的过程 |
| B.将水库中的水闸(钢板)连接一块锌块,可防止水闸被腐蚀 |
| C.由原电池原理知所有的合金都比纯金属更易被腐蚀 |
| D.铜板上的铁铆钉处在潮湿的空气中发生:Fe-3e-===Fe3+,从而形成铁锈,但此过程铜不被腐蚀 |
下列关于实验现象的描述不正确的是 ( )
| A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 |
| B.用锌片作负极,铁片作正极,稀硫酸为电解质溶液一段时间后,溶液PH增大 |
| C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁 |
| D.铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓海轮腐蚀 |
下列关于金属腐蚀的叙述正确的是( )
| A.本质是:M + nH2O = M(OH)n + n/2 H2↑ |
| B.电化学腐蚀必须在酸性条件下进行 |
| C.化学腐蚀比电化学腐蚀更普遍 |
| D.本质是:M – ne- = Mn+[ |
下列关于金属腐蚀正确的是 ( )
A.金属在潮湿空气中的腐蚀的实质是;M+nH2O===M(OH)n+ H2↑ H2↑ |
| B.金属的化学腐蚀的实质是M-ne-===Mn+,电子直接转移给氧化剂 |
| C.金属的化学腐蚀必须在酸性条件下进行 |
| D.在潮湿的中性环境中,金属不会发生电化学腐蚀 |
下列容器中盛有海水,纯铁在其中被腐蚀时,由快到慢的顺序是 ( )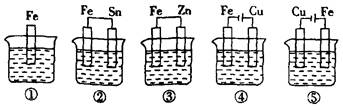
| A.⑤②①④③ | B.③②⑤①④ |
| C.⑤④②③① | D.⑤②①③④ |
钢铁发生吸氧腐蚀时,正极上发生的电极反应是
| A.2H++2e- =H2↑ | B.Fe2++2e- =Fe |
| C.2H2O+O2+4e-=4OH- | D.Fe3++e-=Fe2+ |
家用铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是
| A.4Fe(OH)2+2H2O+O2=4Fe(OH)3 | B.2Fe+2H2O+O2=2Fe(OH)2 |
| C.2H2O+O2+4e- =4OH- | D.Fe-3e-=Fe3+ |
下图装置中,U型管内为红墨水,a.b试管内分别盛有食盐水和氯化铵溶液(溶液呈弱酸性),各加入生铁块,放置一段时间。下列有关描述错误的是
| A.生铁块中的碳是原电池的正极 |
| B.红墨水柱两边的液面变为左低右高 |
| C.两试管中相同的电极反应式是:Fe-2e-=Fe2+ |
| D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀 |
下列说法不正确的是( )
| A.铸铁输油管道应埋在干燥致密不透气的土壤中 |
| B.在空气中,金属铝表面能迅速被氧化形成保护膜,因此铝不容易被腐蚀 |
| C.钢铁发生电化学腐蚀时,负极发生的反应是2H2O+O2+4e-= 4OH- |
| D.白铁(镀Zn铁)表面有划损时,也能阻止铁被氧化 |