对下列装置的叙述错误的是
| A.X如果是硫酸铜,a和b分别连接直流电源正、负极,一段时间后铁片质量增加 |
| B.X如果是氯化钠,则a和b连接时,该装置可模拟生铁在食盐水中被腐蚀的过程 |
| C.X如果是硫酸铁,则不论a和b是否用导线连接,铁片均发生氧化反应 |
| D.X如果是氢氧化钠,将碳电极改为铝电极,a和b用导线连接,此时构成原电池铁作负极 |
化学与生产、生活密切相关。下列叙述正确的是
| A.使用含有氯化钠的融雪剂会加快桥梁的腐蚀 |
| B.“海水淡化”可以解决“淡水供应危机”,向海水中加入净水机明矾可以使海水淡化 |
| C.煤经过气化、液化等物理变化可得到清洁燃料 |
| D.棉花、羊毛、木材和草类的主要成分都是纤维素 |
一定条件下,某含碳钢腐蚀情况与溶液pH的关系如下表。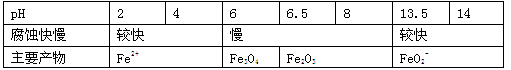
下列说法错误的是
| A.当pH<4时,碳钢主要发生析氢腐蚀 |
| B.当pH>6时,碳钢主要发生吸氧腐蚀 |
| C.当pH>14时,正极反应为O2 + 4H+ + 4e- =2H2O |
| D.将碱性溶液煮沸除去氧气后,碳钢腐蚀的速率会减缓 |
下列有关说法正确的是
| A.白铁(镀锌铁皮)镀层破损后铁仍不易腐蚀 |
B.CH3Cl(g)+Cl2(g) CH2Cl2(l)+HCl(g)能自发进行,则该反应的ΔH>0 CH2Cl2(l)+HCl(g)能自发进行,则该反应的ΔH>0 |
| C.MnS悬浊液中滴加少量CuSO4溶液可生成CuS沉淀,则Ksp(CuS)< Ksp(MnS) |
| D.合成氨生产中将NH3液化分离,一定能加快正反应速率,提高H2的转化率 |
下列事实不能用电化学理论解释的是
| A.镁片不用特殊方法保存 |
| B.镀锌的铁比镀锡的铁耐用 |
| C.轮船水线以下的船壳上装一定数量的锌块以保护船体 |
| D.纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后速率加快 |
钢铁发生电化学腐蚀时,负极发生的反应是
| A.2H++2e—=H2 | B.2H2O+O2+4e—=4OH— |
| C.Fe一2e—=Fe2+ | D.4OH—一4e—=2H2O+O2 |
下列有关金属腐蚀与防护的说法正确的是
| A.纯银器表面在空气中因电化学腐蚀渐渐变暗 |
| B.当镀锡铁制品的镀层破损时,镶层仍能对铁制品起保护作用 |
| C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
| D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
.家用铁锅用水清洗放置后,出现红棕色的锈斑,在此过程中不发生的化学反应是
| A.4Fe(OH)2 + 2H2O + O2 ="=" 4Fe(OH)3 |
| B.2Fe + 2H2O + O2 ="=" 2Fe(OH)2 |
| C.2H2O + O2 + 4e-== 4OH- |
| D.Fe – 3e-== Fe3+ |
下图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液(呈酸性),各加入生铁块,放置一段时间。下列有关描述正确的是
| A.生铁块中的碳是原电池的正极,发生氧化反应 |
| B.红墨水柱两边的液面变为左低右高 |
| C.两试管中相同的负极的电极反应式是:Fe-3e-=Fe 3+ |
| D.a、b试管中均发生了化学能转化为电能的能量变化过程 |
下列事实不能用电化学理论解释的是
| A.锅炉的内壁镶嵌有一定量的锌块 | B.镀锌的铁制品比镀锡的铁制品耐用 |
| C.用铝质铆钉接铁板,铁不易被腐蚀 | D.铝片不用特殊方法保存 |
下列有关金属腐蚀与防护的说法不正确的是
| A.钢铁在弱碱性条件下发生电化学腐蚀的正极反应是:O2+2H2O+4e-===4OH- |
| B.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
| C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
| D.当镀锌铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
如图各容器中盛有海水,铁在其中腐蚀时由快到慢的顺序是
| A.④>②>①>③ | B.②>①>③>④ |
| C.④>②>③>① | D.③>②>④>① |
将一根较纯铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重,下列关于此现象的说法错误的是
| A.铁棒AB段发生反应为O2 + 4e- + 2H2O = 4OH- |
| B.腐蚀过程中在铁棒上会产生微电流,且方向是AB段到BC段 |
| C.向水中加入一定量硫酸钾固体后,对铁棒的生锈速率几乎无影响 |
| D.产生这种现象的本质原因是铁棒所处的化学环境不同 |
下列有关钢铁腐蚀和防护的说法不正确的是
| A.自行车的钢圈上镀一层铬,防止生锈 |
| B.外加直流电源保护钢闸门时,钢闸门与电源的负极相连 |
| C.钢铁发生吸氧腐蚀的正极反应:2H2O +O2+4e-=4OH- |
| D.钢铁发生析氢腐蚀的负极反应:Fe – 3e-=Fe3+ |