下列说法正确的是
| A.工业上常通过电解熔融的MgO冶炼金属镁 |
| B.合金的硬度一般比其成分金属的硬度大 |
| C.钢铁发生吸氧腐蚀时,正极反应是4OH--4e-=2H2O+O2↑ |
| D.在铁上镀铜,应选用铜作阴极 |
下列与金属腐蚀有关的说法正确的是
| A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重 |
| B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小 |
| C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
| D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
在铁制品上镀一定厚度的锌层,以下方案设计正确的是( )。
| A.锌作阳极,铁制品作阴极,溶液中含有锌离子 |
| B.铂作阴极,铁制品作阳极,溶液中含有锌离子 |
| C.铁作阳极,铁制品作阴极,溶液中含有亚铁离子 |
| D.锌作阴极,铁制品作阳极,溶液中含有亚铁离子 |
以下现象与原电池反应无关的是
| A.黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
| B.生铁比软铁芯(几乎是纯铁)容易生锈 |
| C.铁质器件附有铜质配件,在接触处易生铁锈 |
| D.银质奖牌久置后表面变暗 |
镀锌钢管具有广泛的用途,镀锌钢管有冷镀锌管和热镀锌管,冷镀即电镀,热镀是指熔融状态的锌与铁生成合金层。下列说法正确的是
| A.铁锌形成的合金层是纯净物,耐酸碱腐蚀 |
| B.钢管镀锌的目的是使铁与锌形成原电池,消耗锌而保护钢管免受腐蚀 |
| C.钢管冷镀时,钢管作阴极,锌棒作阳极,锌盐溶液作电解质溶液 |
| D.镀锌钢管破损后,负极反应式为Fe-2e-=Fe2+ |
下列反应条件的控制中不恰当的是( )。
| A.为防止铁生锈,在其表面涂一层防锈油漆 |
| B.为防止火灾,在面粉厂、加油站等场所要严禁烟火 |
| C.为加快KClO3的分解速率,加入MnO2 |
| D.为加快H2O2的分解速率,把反应容器放到冷水中冷却 |
各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为( )。
| A.②①③④ | B.④③①② | C.④②①③ | D.③②④① |
糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是( )
| A.脱氧过程是吸热反应,可降低温度,延长糕点保质期 |
| B.脱氧过程中铁作原电池正极,电极反应为:Fe-3e=Fe3+ |
| C.脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e=4OH- |
| D.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |
下列叙述正确的是
| A.酸性氧化物和碱性氧化物都是电解质 |
| B.将NaOH溶液逐滴加入FeCl3溶液可制备Fe(OH)3胶体 |
| C.电化学腐蚀是造成金属腐蚀的主要原因 |
| D.离子键一定只存在于离子化合物中,共价键一定只存在于共价化合物中 |
下列说法错误的是
| A.一定条件下,气体体积大小主要由气体的分子数目决定的 |
| B.有热量变化的过程一定有化学键的断裂与形成 |
| C.通过钠、镁、铝与水反应的实验,可以比较三种单质的金属性强弱 |
| D.轮船外壳连接锌块保护外壳不受腐蚀,是采用了牺牲阳极的阴极保护法 |
下列有关金属腐蚀与防护的说法正确的是
| A.纯银器表面在空气中会因化学腐蚀渐渐变暗 |
| B.地下输油钢管与外加直流电源的正极相连可保护其不受腐蚀 |
| C.海轮外壳连接锌块是采用牺牲阴极的阳极保护法保护外壳不受腐蚀 |
| D.当镀锡铁制品的镀层破损时,锡镀层仍能对铁制品起保护作用 |
如图装置中,小试管内为红墨水,带有支管的U形管中盛有pH=4的雨水和生铁片。经观察,装置中有如下现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U形管中的液面。以下有关解释合理的是( )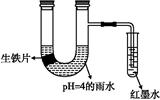
| A.生铁片中的碳是原电池的负极,发生还原反应 |
| B.雨水酸性较强,生铁片始终发生析氢腐蚀 |
| C.墨水液面回升时,正极反应式为:O2+2H2O+4e-=4OH- |
| D.U形管中溶液pH逐渐减小 |
如图所示,各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为( )

| A.②①③④⑤⑥ | B.⑤④②①③⑥ |
| C.⑤④③①②⑥ | D.⑤③②④①⑥ |