下列叙述中不正确的是
| A.将NaAlO2溶液在蒸发皿中蒸干,最终得到的固体物质是Al(OH)3 |
| B.溶液中c(H+)>c(OH—),该溶液一定显酸性 |
| C.用原电池作电源进行电解时,电子从原电池负极流向电解池阴极 |
| D.外加电流的阴极保护法,构成了电解池;牺牲阳极的阴极保护法构成了原电池 |
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
| A.氢氧燃料电池在碱性介质中的负极反应式:O2+2H2O+4e一=4OH- |
| B.电解饱和食盐水时,阳极的电极反应式为:2C1-一2e一 =C12↑ |
| C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu一2e-=Cu2+ |
| D.钢铁发生电化学腐蚀的正极反应式:Fe一2e—=Fe2+ |
如图装置中,小试管内为红墨水,具支试管内盛有一定量pH=4的雨水和生铁片。实验时观察到:开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管内液面。下列说法正确的是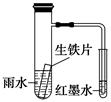
| A.生铁片中的碳是原电池的阳极,发生还原反应 |
| B.雨水酸性较强,生铁片仅发生析氢腐蚀 |
| C.墨水液面回升时,碳电极反应式为O2+2H2O+4e-===4OH- |
| D.具支试管中溶液pH逐渐减小 |
某校活动小组为探究金属腐蚀的相关原理,设计了如下图a所示装置,图a的铁棒末段分别连上一块Zn片和Cu片,并静置于含有K3Fe(CN)6及酚酞的混合凝胶上。一段时间后发现凝胶的某些区域(如下图b示)发生了变化,已知Fe2+可用K3Fe(CN)6来检验(呈蓝色)。则下列说法不正确的是

| A.甲区呈现红色 | B.乙区产生Zn2+ |
| C.丙区发生的电极反应式:Cu-2e-= Cu2+ | D.丁区呈现蓝色 |
家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是
| A.4Fe(OH)2+2H2O+O2=4Fe(OH)3 | B.2Fe+2H2O+O2=2Fe(OH)2 |
| C.2H2O+O2+4e-=4OH- | D.Fe-3e-=Fe3+ |
下列有关金属腐蚀与防护的说法正确的是
| A.纯银器表面在空气中渐渐变暗是因为电化学腐蚀 |
| B.当镀锌铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了外加直流电源的阴极保护法 |
| D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
如下图所示,各容器中盛有海水,铁在其中被腐蚀时,由快到慢的顺序是
| A.4>2>1>3 | B.2>1>3>4 |
| C.4>2>3>1 | D.3>2>4>1 |
下列有关说法正确的是
| A.纯碱溶液加水稀释,溶液中所有离子浓度均减小 |
| B.镀锡铁制品镀层受损后,铁制品比受损前更易被腐蚀 |
| C.将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
| D.合成氨反应需使用催化剂,说明催化剂可以促进该平衡向生成氨的方向移动 |
出土的锡青铜(铜锡合金)文物常有Cu2(OH)3Cl覆盖在其表面。下列说法不正确的是
| A.锡青铜的熔点比纯铜高 |
| B.在自然环境中,锡青铜中的锡可对铜起保护作用 |
| C.锡青铜文物在潮湿环境中的腐蚀比干燥环境中快 |
| D.生成Cu2(OH)3Cl覆盖物是电化学腐蚀过程,但不是化学反应过程 |
一定条件下,有关金属腐蚀的下列说法不正确的是
| A.为减缓金属腐蚀,可将要保护的金属物件与外电源的正极相连接做阴极 |
| B.在pH<5的溶液中,金属主要发生析氢腐蚀 |
| C.钢铁制品吸氧腐蚀时正极反应为:O2+2H2O+4e-=4OH- |
| D.在金属物件表面涂上机油可防止金属生锈从而使金属保持光泽 |
下列叙述不正确的是
| A.锌跟稀硫酸反应制取氢气,加入少量的硫酸铜能加快反应速率 |
| B.镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易被腐蚀 |
| C.为保护海轮的船壳,常在船壳外面镶上锌块 |
| D.钢铁在发生析氢腐蚀和吸氧腐蚀时,负极反应是相同的 |
如图,向还原铁粉中加入少量的炭粉,混合均匀后,撒入内壁用NaCl溶液润湿过的具支试管中,塞紧橡皮塞。几分钟后,打开止水夹,观察到导管中水柱上升。对此过程所作的分析正确的是
| A.铁粉在电化学腐蚀过程中作正极 | B.炭粉被氧化 |
| C.发生了吸氧腐蚀 | D.发生了析氢腐蚀 |