据环保部门测定,我国一些大城市的酸雨pH=3.5。在酸雨季节铁制品极易腐蚀,则在其腐蚀中正极发生的反应是
| A.Fe -2e-=Fe2+ | B.2H2O+O2+4e-=4OH- |
| C.4OH-- 4e-=2H2O+O2↑ | D.2H++2e-=H2↑ |
钢铁生锈过程发生如下反应: ①2Fe+O2+2H2O=2Fe(OH)2;
①2Fe+O2+2H2O=2Fe(OH)2; ②4Fe(OH)2+O2+2H2O=4Fe(OH)3;
②4Fe(OH)2+O2+2H2O=4Fe(OH)3; ③2Fe(OH)3=Fe2O3+3H2O。
③2Fe(OH)3=Fe2O3+3H2O。 下列说法正确的是( )
下列说法正确的是( )
A.反应①、②中电子转移数目相等 |
B.反应①中氧化剂是氧气和水 |
C.与铜质水龙头连接处的钢质水管不易发生腐蚀 |
D.钢铁在潮湿的空气中不能发生电化学腐蚀 |
在火烧圆明园时流失了大量的国宝,如:铜铸的鼠首和兔首。普通铜器时间稍久容易出现铜绿,其主要成分是〔Cu2(OH)2CO3〕,这两件1760年铜铸的国宝在240多年后看上去仍然熠熠生辉不生锈,下列对其原因的分析最可能的是:
| A.它们的表面都电镀上了一层耐腐蚀的黄金 |
| B.环境污染日趋严重,它们表面的铜绿被酸雨溶解洗去 |
| C.铜的金属活动性比氢小,因此不易被氧化 |
| D.它是含一定比例金、银、锡、锌的铜合金 |
钢铁发生吸氧腐蚀时,正极上发生的电极反应是( )
| A.2H+ + 2e- ="==" H2↑ | B.Fe2+ + 2e- ="=" Fe |
| C.2H2O + O2 + 4e- ="==" 4OH- | D.Fe3+ + e- ="==" Fe2+ |
如图装置中, a、b试管内分别盛有食盐水和氯化铵溶液,各加入一块生铁片,放置一段时间。下列有关描述错误的是
| A.红墨水柱两边的液面变为左低右高 |
| B.两块生铁片均发生电化学腐蚀 |
| C.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀 |
| D.两试管中相同的电极反应式为Fe → Fe2+ + 2e- |
浸出-萃取-电积法已成为铜湿法冶金的主要工艺过程。以黄铜铜为原料,采用电积法生产阴极铜生产线,主要生产工艺为:
黄铜铜→硫酸浸出→过滤→萃取→反萃→电积→阴极铜。
(1)浸出是用浸矿剂将铜矿石中的铜进入溶液中。据报道,有一种叫Thibacillus Ferroxidans的细菌在氧气存在下,酸性溶液中,将黄铜矿氧化成硫酸盐,写出用硫酸浸出黄铜矿发生反应的离子方程式: 。
(2)萃取是利用特效铜萃取剂在含铜、铁及其碱性金属离子的低浓度含杂浸出液中有选择性地使铜离子萃入有机相,将铜离子与其它金属离子有效地分离,并通过反萃取使低浓度铜离子的原液富集成适宜电积要求的硫酸铜溶液。萃取过程的化学平衡为:2RH+Cu2+ R2Cu+2H+。则萃取和反萃取进行的程度受 和 的影响。
R2Cu+2H+。则萃取和反萃取进行的程度受 和 的影响。
(3)电积是将萃取富集后的铜溶液电解沉积出阴极铜。右图为用惰性阳极电积阴极铜的装置图:
①在图示方框中标出电源的正负极。
②写出电积阴极铜的总反应 。
(4)金属铜长期露置于空气中容易生锈,铜锈的主要成分为 ,请利用电化学原理画出防止铜腐蚀的装置图。
2008年10月8日,瑞典皇家科学院宣布美籍华裔科学家钱永健获得2008年度诺贝尔化学奖.少年时代,他就对化学产生了浓厚的兴趣。16岁时,他凭借一个金属易受硫氰酸盐腐蚀的调查项目,荣获具有“少年诺贝尔奖”之称的著名奖项。下列说法正确的是
| A.金属腐蚀就是金属失去电子被还原的过程 |
| B.将水库中的水闸(钢板)连接一块锌块,可防止水闸被腐蚀 |
| C.由原电池原理知所有的合金都比纯金属更易被腐蚀 |
| D.铜板上的铁铆钉处在潮湿的空气中发生:Fe-3e-===Fe3+,从而形成铁锈,但此过程铜不被腐蚀 |
下列关于金属腐蚀正确的是 ( )
A.金属在潮湿空气中的腐蚀的实质是;M+nH2O===M(OH)n+ H2↑ H2↑ |
| B.金属的化学腐蚀的实质是M-ne-===Mn+,电子直接转移给氧化剂 |
| C.金属的化学腐蚀必须在酸性条件下进行 |
| D.在潮湿的中性环境中,金属不会发生电化学腐蚀 |
下列容器中盛有海水,纯铁在其中被腐蚀时,由快到慢的顺序是 ( )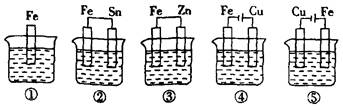
| A.⑤②①④③ | B.③②⑤①④ |
| C.⑤④②③① | D.⑤②①③④ |
家用铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是
| A.4Fe(OH)2+2H2O+O2=4Fe(OH)3 | B.2Fe+2H2O+O2=2Fe(OH)2 |
| C.2H2O+O2+4e- =4OH- | D.Fe-3e-=Fe3+ |
下图装置中,U型管内为红墨水,a.b试管内分别盛有食盐水和氯化铵溶液(溶液呈弱酸性),各加入生铁块,放置一段时间。下列有关描述错误的是
| A.生铁块中的碳是原电池的正极 |
| B.红墨水柱两边的液面变为左低右高 |
| C.两试管中相同的电极反应式是:Fe-2e-=Fe2+ |
| D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀 |
下图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的是( )
| A.生铁块中的碳是原电池的正极 |
| B.红墨水柱两边的液面变为左低右高 |
| C.两试管中相同的电极反应式是:Fe-2e―→Fe2+ |
| D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀 |
铁生锈是比较常见的现象,某实验小组,为研究铁生锈的条件,设计了以下快速.易行的方法:

首先检查制氧气装置的气密性,然后按图连接好装置,点燃酒精灯给药品加热,持续3分钟左右,观察到的实验现象为:①直形管中用蒸馏水浸过的光亮铁丝表面颜色变得灰暗,发生锈蚀;②直形管中干燥的铁丝表面依然光亮,没有发生锈蚀;③中潮湿的铁丝依然光亮。
试回答以下问题:
(1)由于与接触的介质不同,金属腐蚀分成不同类型,本实验中铁生锈属于___________。
能表示其原理的反应方程式为_____________________________________
(2)仪器A的名称为______________,其中装的药品可以是_____ __________,其作用是___________________________________________
(3)由实验可知,该类铁生锈的条件为_______________________________________。决定铁生锈快慢的一个重要因素是_____________________________________________