下列说法正确的是
| A.氯碱工业中,烧碱在阳极区生成 |
| B.电解熔融氯化铝冶炼金属铝 |
| C.电镀时,用镀层金属作阳极 |
| D.将钢闸门与外电源正极相连,可防止其腐蚀 |
用如图示的方法可以保护钢质闸门.下列说法正确的是( )

| A.当a、b间用导体连接时,则X应发生氧化反应 |
| B.当a、b间用导体连接时,则X可以是锌或石墨 |
| C.当a、b与外接电源相连时,a应连接电源的正极 |
| D.当a、b与外接电源相连时,阴极的电极反应式:2Cl﹣﹣2e→Cl2↑ |
(1)有A、B、C、D四种金属。将A与B用导线连接起来,浸入电解质溶液中,B不易腐蚀;将A、D分别投入等浓度盐酸中,D比A反应剧烈;将铜浸入B的盐溶液里,无明显变化;如果把铜浸入C的盐溶液里,有金属C析出。据此,判断它们的活动性由强到弱的顺序是
(2)下列装置可防止铁棒被腐蚀的是 
(3)将经过酸洗除锈的铁钉,用饱和食盐水浸泡后放入如图所示装置中,过一段时间观察,导管中的水柱会上升,说明发生的是 (填“吸氧腐蚀”或“析氢腐蚀”)。写出相关的电极反应式:负极 ,正极 
I.肼(N2H4)又称联氨,在常温下是一种可燃性的液体,可用作火箭燃料。 已知在25℃、l0lkPA时,16gN2H4在氧气中完全燃烧生成氮气和H2O,放出热量312kJ。
(1)该条件下,N2H4完全燃烧的热化学方程式为
(2)传统制备肼的方法是以NAClO氧化NH3,制得肼的稀溶液,该反应的方程式为
II.钢铁工业是国家工业的基础。请回答钢铁腐蚀、防护过程中的有关问题。
(1)铁在潮湿的空气中容易被腐蚀,写出铁发生电化学腐蚀时,负极的电极反应式
(2)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。图中A、B、C、D四个区域,生成铁锈最多的是 (填字母)
(3)下列各个装置中铁棒被腐蚀由难到易的顺序是______(填字母)
下列各装置中都盛有0.1 mol·Lˉ1的NaCl溶液,放置一定时间后,锌片的腐蚀速率由快到慢的顺序是
| A.③①④② | B.②①④③ | C.①②③④ | D.①②④③ |
右图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和稀盐酸,各加入生铁块,放置一段时间。下列有关描述错误的是
| A.生铁块中的碳是原电池的正极 |
| B.红墨水柱两边的液面变为左低右高 |
| C.两试管中相同的电极反应式是:Fe-2e-=Fe2+ |
| D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀 |
钢铁发生电化学腐蚀时,负极发生的反应是
| A.2H++2e—=H2 | B.2H2O+O2+4e—=4OH— |
| C.Fe一2e—=Fe2+ | D.4OH—一4e—=2H2O+O2 |
由下列实验及现象不能推出相应结论的是( )
| |
实验 |
现象 |
结论 |
| A. |
向 的 溶液中加足量铁粉,振荡,加1滴KSCN溶液 |
黄色逐渐消失,加KSCN溶液颜色不变 |
还原性: |
| B. |
将金属钠在燃烧匙中点燃,迅速伸入集满 的集气瓶 |
集气瓶中产生大量白烟,瓶内有黑色颗粒产生 |
具有氧化性 |
| C. |
加热盛有少量 固体的试管,并在试管口放置湿润的红色石蕊试纸 |
石蕊试纸变蓝 |
显碱性 |
| D. |
向2支盛有 相同浓度银氨溶液的试管中分别加入2滴相同浓度的 和 溶液 |
一只试管中产生黄色沉淀,另一支中无明显现象 |
|
下列实验操作规范且能达到目的的是( )
| |
目的 |
操作 |
| A. |
取 盐酸 |
在 酸式滴定管中装入盐酸,调整初始读数为 后,将剩余盐酸放入锥形瓶 |
| B. |
清洗碘升华实验所用试管 |
先用酒精清洗,再用水清洗 |
| C. |
测定醋酸钠溶液 |
用玻璃棒蘸取溶液,点在湿润的 试纸上 |
| D. |
配制浓度为 的 溶液 |
称取 固体 ,放 容量瓶中,加水溶解并稀释至刻度 |
下列四个装置图均与电化学有关,请根据图示回答相关问题:
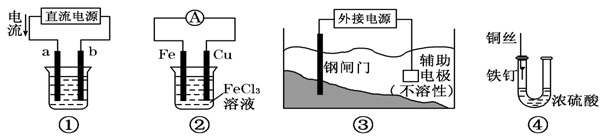
(1)这四个装置中,利用电解原理的是 (填装置序号);
(2)装置①若用来精炼铜,则a极的电极材料是 (填“粗铜”或“精铜”),电解质溶液为 ;
(3)装置②的总反应方程式是 ;
(4)装置③中钢闸门应与外接电源的 极相连(填“正”或“负”)
(5)装置④中的铁钉几乎没被腐蚀,其原因是 。
关于下列各装置图的叙述中,不正确的是
| A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 |
| B.装置②的总反应式是Cu+2Fe3+====Cu2++2Fe2+ |
| C.装置③中钢闸门应与外接电源的负极相连 |
| D.装置④中的铁钉几乎没被腐蚀 |
金属的腐蚀除化学腐蚀和普通的电化学腐蚀外,还有“氧浓差腐蚀”,如在管道或缝隙等处的不同部位氧的浓度不同,在氧浓度低的部位是原电池的负极。下列说法正确的是
| A.纯铁的腐蚀属于电化学腐蚀 |
| B.钢铁吸氧腐蚀时,负极的电极反应式为Fe﹣3e﹣=Fe3﹢ |
| C.海轮在浸水部位镶一些铜锭可起到抗腐蚀作用 |
| D.在图示氧浓差腐蚀中,M极处发生的电极反应为O2+2H2O+4e﹣=4OH﹣ |
下列描述中,不符合生产实际的是
| A.电解熔融的氧化铝制取金属铝,用铁作阳极 |
| B.电解法精炼粗铜,用纯铜作阴极 |
| C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 |
| D.在镀件上电镀锌,用锌作阳极 |