有一瓶澄清溶液,可能含有NH4+、K+、Na+、Mg2+、Ba2+、Al3+、Fe3+、Cl-、I-、NO3-、CO32-、SO42-中的一种或几种。取该溶液进行以下实验:
①用pH试纸检验,表明溶液呈强酸性;
②取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡CCl4层呈紫红色;
③另取部分溶液,向其中逐滴加入NaOH溶液,使溶液从酸性变为碱牲,在滴加过程中先生成白色沉淀后完全溶解;取部分碱性溶液加热,有气体放出,该气体能使润湿的红色石蕊试纸变蓝。
④另取部分③中的碱性溶液,向其中加入Na2CO3溶液,有白色沉淀生成。
根据以上实验事实回答下列问题:
(1)该溶液中肯定存在的离子是 ,肯定不存在的离子是 ;
(2)步骤③加入NaOH溶液过程中先生成白色沉淀后完全溶解的离子方程式为 ;
(1)将下列离子Na+、K+、Cu2+、H+、NO3-、Cl-、CO32-、OH-按可能大量共存于同一溶液的情况,把他们分成A、B两组。
A组显酸性,除H+ 外还有 、 、 离子
B组显碱性,除OH-外还有 、 、 离子
(2)实验室制备氢氧化铁胶体的方法是 ;
反应的化学方程为 。
电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导 率变化可以确定滴定反应的终应。右图是KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。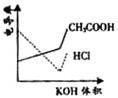
下列示意图中,能正确表示用NH3·H2O溶液滴定 HCl和CH3COOH混合溶液的滴定曲线的是
HCl和CH3COOH混合溶液的滴定曲线的是 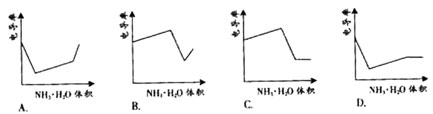
某溶液中含有HCO3-、SO32-、SiO32-、Cl-等四种离子,若向其中加入某种试剂后,发现溶液中仅有HCO3-、SO32-两种离子数量大量减少。则加入的试剂可能是( )
| A.盐酸 | B.Na2O2 | C.双氧水 | D.BaCl2溶液 |
有一透明溶液甲,欲确定是否含有下列离子:Na+、Mg2+、Al3+、Ba2+、SO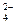 、Cl-、I-、HCO
、Cl-、I-、HCO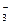 ,现取该溶液实验如下:
,现取该溶液实验如下:
| 实验步骤 |
实验现象 |
| ①取少量甲溶液,滴加几滴甲基橙 |
溶液变红色 |
| ②取少量甲溶液,滴加Ba(NO3)2溶液 |
溶液无明显变化 |
| ③取②中实验后的溶液,滴加AgNO3溶液 |
有白色沉淀生成,且不溶于HNO3 |
| ④取少量甲溶液,滴加NaOH溶液 |
有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
(1)由实验步骤①判断出溶液中肯定不存在的离子是 ,能说明这一实验事实的离子方程式是
(2)实验步骤③的实验结果说明溶液中不存在 离子
(3)欲确定的离子中肯定存在的是 。
(4)为进一步确定其他离子,应该补充的实验是
| A.蒸发 | B.过滤 | C.焰色反应 | D.渗析 |
某溶液中含有Ba2+、Cu2+、Ag+、Mg2+等四种金属阳离子,现欲将这四种阳离子逐一沉淀下来。某学生设计了如下四种方案。所选试剂及顺序如下:
甲方案:Na2SO4溶液、稀盐酸、H2S、NaOH溶液
乙方案:稀盐酸、Na2SO4溶液、H2S、NaOH溶液
丙方案:NaCl溶液、Na2SO4溶液、NaOH溶液、Na2S溶液
丁方案:Na2S溶液、Na2SO4溶液、NaCl溶液、NaOH溶液
试回答:
(1) 你认为可行的方案是__________方案,反应的离子方程式有:__________________。
(2)方案__________不可行的原因是:________________________________________。
方案__________不可行的原因是:________________________________________。
方案__________不可行的原因是:________________________________________。
按下列要求填空(共12分)
①向碳酸氢钙溶液中加入少量氢氧化钠溶液的离子方程式:________________________。
氯化铝溶液与NaHCO3溶液混合的离子方程式:_____________________________________。
②在KClO3 + 6HCl =" KCl" + 3Cl2↑ + 3H2O的反应中,被氧化的氯原子与被还原的氯原子的物质的量之比是_______________。
③强酸性的未知无色溶液中可能含有大量的Cl-、S2-、NO3-、CO32-、NH4+、Cu2+、Fe3+、Ag+等,现已检出有Ag+,你认为其中 __ __离子还需要鉴定是否存在,请写出检验该离子的离子方程式_____________________。
④某化合物的相对分子质量为m,在t℃时AmL该化合物的饱和溶液为Bg,将其蒸干后得到固体Cg。该化合物在t℃时的溶解度 为 __g,该饱和溶液中溶质的物质的
为 __g,该饱和溶液中溶质的物质的 量浓度为 mol/L。
量浓度为 mol/L。
有一瓶澄清的溶液,其中可能含有NH4+、 K+、 Na+ 、 Mg2+、 Ba2+、 Al3+、
Fe3+、Cl-、Ⅰ-、 NO3-、CO32 -、SO42-中的几种,取该溶液进行以下实验:
(1)取pH试纸检验,溶液呈强酸性;
(2)取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4层呈紫红色;
(3)另取出部分溶液,逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生;
(4)取出部分上述碱性溶液加Na2CO3溶液后,有白色沉淀生成;。
(5)根据以上实验事实确定①该溶液肯定存在的离子是 ;②肯定不存在的离子是_____________________________;③还不能确定的离子是________________________,要确定其中的阳离子可利用的方法原理是________________
下列事实能说明醋酸属于弱电解质的是
①中和10mL1mol/LCH3COOH溶液需要10mL1mol/LNaOH溶液
②相同条件下,完全相同的两块锌粒分别跟盐酸和醋酸反应,前者的速率快
③0.01mol/L醋酸溶液的pH大于2
④0.1mol/LCH3COONa溶液显碱性
| A.①②③ | B.②③④ | C.②③ | D.①④ |
含等物质的量NaOH的溶液分别用pH为2和3的CH3COOH溶液中和,设消耗CH3COOH溶液的体积依次为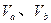 ,则两者的关系正确的是
,则两者的关系正确的是
A.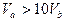 |
B.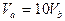 |
C.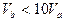 |
D. |
下列电解质中,①NaCl;②NaOH;③NH3·H2O;④CH3COOH;⑤BaSO4;⑥AgCl;⑦Na2O;⑧K2O;⑨H2O,________________是强电解质;______________是弱电解质