汽车尾气中的主要污染物是NO和CO。为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1)2NO(g)+2CO(g) 2CO2(g)+N2(g) △H=-746.5KJ/mol (条件为使用催化剂)
2CO2(g)+N2(g) △H=-746.5KJ/mol (条件为使用催化剂)
已知:2C (s)+O2(g) 2CO(g) △H=-221.0KJ/mol
2CO(g) △H=-221.0KJ/mol
C (s)+O2(g) CO2(g) △H=-393.5KJ/mol
CO2(g) △H=-393.5KJ/mol
则N2(g)+O2(g)=2NO(g) △H= kJ·mol-1。
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| C(NO)10-4 mol/L |
10.0 |
4.50 |
C1 |
1.50 |
1.00 |
1.00 |
| C(NO)10-3 mol/L |
3.60 |
3.05 |
C2 |
2.75 |
2.70 |
2.70 |
则c1合理的数值为 (填字母标号)。
A.4.20 B.4.00 C.3.50 D.2.50
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率。根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如下图所示:
则曲线Ⅰ对应的实验编号依次为 。
(4)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| H2O |
CO |
CO |
H2 |
|||
| ① |
650 |
2 |
4 |
2.4 |
1.6 |
5 |
| ② |
900 |
1 |
2 |
1.6 |
0.4 |
3 |
| ③ |
900 |
a |
b |
c |
d |
t |
①实验组①中以v(CO2)表示的反应速率为 ,温度升高时平衡常数会 (填“增大”、“减小”或“不变”)。
②若a=2,b=1,则c= ,达平衡时实验组②中H2O(g)和实验组③中CO的转化率的关系为
α2 (H2O) α3 (CO)(填“<”、“>”或“=”)。
(5)CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-。
①则负极的电极反应式为________________。
②以上述电池为电源,通过导线连接成图一。若X、Y为石墨,a为2L 0.1mol/L KCl溶液,写出电解总反应的离子方程式 。电解一段时间后,取25mL上述电解后的溶液,滴加0.4mol/L醋酸得到图二曲线(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。根据图二计算,上述电解过程中消耗一氧化碳的质量为__________g。
硫在地壳中主要以硫化物、硫酸盐等形式存在,其单质和化合物在工农业生产中有着重要的应用。
(1)某科研小组用SO2为原料制取硫酸。
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池的负极的电极反应式 。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如图所示。电解时阳极区会产生气体,产生气体的原因是 。
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
①用离子方程式表示反应器中发生的反应是 。
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是 。
(3)氢化亚铜是一种红色固体,可由硫酸铜为原理制备
4CuSO4 + 3H3PO2 + 6H2O="4CuH↓" + 4H2SO4 + 3H3PO4。
①该反应中还原剂是 (写化学式)。
②该反应每生成1molCuH,转移的电子物质的量为 。
(4)硫酸铜晶体常用来制取波尔多液,加热时可以制备无水硫酸铜。将25.0 g胆矾晶体放在坩埚中加热测定晶体中结晶水的含量,固体质量随温度的升高而变化的曲线如下图。
请分析上图,填写下列空白:
①30℃~110℃间所得固体的化学式是 ,
②650℃~1000℃间所得固体的化学式是 。
SO2、NO是大气污染物。吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
(1)装置Ⅰ中生成HSO3-的离子方程式为 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如图所示。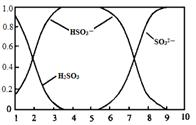
①下列说法正确的是 (填字母序号)。
a.pH=8时,溶液中c(HSO3-) < c(SO32-)
b.pH=7时,溶液中c(Na+) =c(HSO3-)+c(SO32-)
c.为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
(3)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,写出生成NO3-的离子方程式 。
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。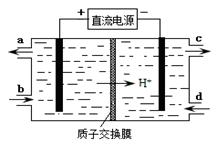
①生成Ce4+的电极反应式为 。
②生成Ce4+从电解槽的 (填字母序号)口流出。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L(用含a代数式表示,计算结果保留整数).
世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。实验室以电解法制备ClO2的流程如下:
已知:①NCl3是黄色黏稠状液体或斜方形晶体,极易爆炸,有类似氯气的刺激性气味,自然爆炸点为95℃,在热水中易分解,在空气中易挥发,不稳定。
②气体B能使湿润的红色石蕊试纸变蓝。
回答下列问题:
(1)电解时,发生反应的化学方程式为 。
实验室制备气体B的化学方程式为 ,为保证实验的安全,在电解时需注意的问题是:①控制好生成NCl3的浓度;② 。
(2)NCl3与NaClO2(亚氯酸钠)按物质的量之比为1∶6混合,在溶液中恰好反应生成ClO2,该反应的离子方程式为 。
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10 mL,稀释成100 mL试样;
步骤2:量取V1 mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30 min。
步骤3:以淀粉溶液作指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
(已知I2+2S2O32-=2I-+S4O62-)
①上述步骤3中滴定终点的现象是 ;
②根据上述步骤可计算出原ClO2溶液的浓度为 g /L(用含字母的代数式表示)。
Ⅰ、醉驾对人们的安全危害很大,利用下列原理可以检查司机是否酒后开车。
2K2Cr2O7(橙色)+3C2H5OH+H2SO4 →Cr2(SO4)3(绿色)+K2SO4+CH3COOH+H2O
①配平化学方程式后,H2O前面的系数为 ;
②怎样判断司机是酒后开车: 。
③写出用粮食酿酒的化学方程式: ; 。
Ⅱ、下列框图中,A由两种黑色金属氧化物等物质的量混合而成,B中含有四种阳离子。据此回答下列问题:
(1)A的组成是 (填化学式)。
(2)相同条件下,溶液B中所有阳离子的氧化性由强到弱的顺序依次是 。
(3)A中某组分可由单质与水反应制得,化学方程式为: 。
(4)电解所用装置如图所示。
①电解开始阶段,阳极上的电极反应是 ,阴极上的电极反应是 。
②电解至阴极刚开始有固体R析出时,该溶液中金属离子浓度由大到小的顺序是 。
煤粉中的氮元素在使用过程中的转化关系如下图所示:
(1)②中NH3参与反应的化学方程式为 。
(2)③中加入的物质可以是 (填字母序号)。
a.空气 b.CO c.KNO3 d.NH3
(3)焦炭氮中有一种常见的含氮有机物吡啶( ),其分子中相邻的C和N原子相比,N原子吸引电子能力更 (填“强”或“弱”),从原子结构角度解释原因: 。
),其分子中相邻的C和N原子相比,N原子吸引电子能力更 (填“强”或“弱”),从原子结构角度解释原因: 。
(4)已知:N2(g) + O2(g) 2NO(g) ΔH =" a" kJ·mol-1
2NO(g) ΔH =" a" kJ·mol-1
N2(g) + 3H2(g) 2NH3(g) ΔH =" b" kJ·mol-1
2NH3(g) ΔH =" b" kJ·mol-1
2H2(g) + O2(g) 2H2O(l) ΔH =" c" kJ·mol-1
2H2O(l) ΔH =" c" kJ·mol-1
反应后恢复至常温常压,①中NH3参与反应的热化学方程式为 。
(5)用间接电化学法除去NO的过程,如下图所示:
已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式: 。
用离子方程式表示吸收池中除去NO的原理: 。
I.Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为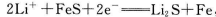 ,则该电池的总反应式为_____________________。
,则该电池的总反应式为_____________________。
Ⅱ.锂一黄铁矿高容量电池,由于其污染小、成本低、电容量大、黄铁矿储备丰富而有望取代目前市场的碱性电池。制取高纯度黄铁矿的工艺流程如下: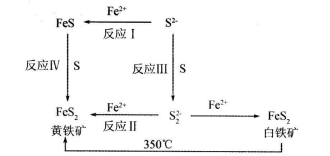
(1)已知: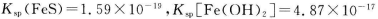 ,为得到较纯的FeS沉淀,最好在FeCl2溶液中加入的试剂为_________(填序号)
,为得到较纯的FeS沉淀,最好在FeCl2溶液中加入的试剂为_________(填序号)
A.(NH4)2S B.CuS C.H2S D.Na2S
(2)关于白铁矿与黄铁矿下列判断错误的是_____________(填序号)
A.属于同素异形体
B.因为晶体结构不同而导致性质有差别
C.黄铁矿比白铁矿更稳定
(3)反应Ⅲ制取 S22-时,溶液必须保持为碱性,除了S2- 与酸反应外,还有更重要的原因是(用离子方程式表示)___________________________.
(4)室温下,Li/FeS2二次电池所用的电解质是非水液体电解质,放电行为与温度有关。
①该电池电解质为非水液体电解质,原因是____________________________________.
②温度低时,锂与FeS2反应只生成A物质,产生第一次放电行为;温度升高,锂与A继续反应(产物之一为Fe),产生第二次放电行为。若二次行为均进行完全且放电量恰好相等。请写出化学反应方程式:
第一次放电:__________________;第二次放电:__________________________。
(5)制取高纯度黄铁矿的另一种方法是:以LiCl- KC1低共熔点混合物为电解质,FeS为阳极,Al为阴极,在适当的电压下电解。写出阳极反应式___________________________。
(共16分)Ⅰ.CO和H2作为重要的燃料和化工原料,有着十分广泛的应用。
(1)已知:C(s)+O2(g)=CO2(g) △H1= -393.5 kJ·mol-1
C(s)+H2O(g)= CO(g)+H2(g) △H2= +131.3 kJ·mol-1
则反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)△H= kJ·mol-1。
(2)利用反应CO(g) +H2(g)+O2(g) = CO2(g) +H2O(g)设计而成的MCFS燃料电池是用水煤气(CO和H2物质的量之比为1:1)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质的一种新型电池。现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,反应装置以及现象如图所示。则有: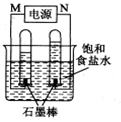
①燃料电池即电源的N极的电极反应式为 _______________________ ;
②已知饱和食盐水的体积为1 L,一段时间后,测得左侧试管中气体体积为11.2 mL(标准状况),若电解前后溶液的体积变化忽略不计,而且电解后将溶液混合均匀,则此时溶液的pH为 。
Ⅱ.CO和NO是汽车尾气的主要污染物。消除汽车尾气的反应式之一为:
2NO(g)+2CO(g) N2(g)+2CO2(g)。请回答下列问题:
N2(g)+2CO2(g)。请回答下列问题:
(3)一定温度下,在一体积为VL的密闭容器中充人一定量的NO和CO时,反应进行到t时刻时达到平衡状态,此时n(CO)=amol、n(N0)=2amol、n(N2)=bmol,且N2占平衡混合气体总体积的1/4。
①该反应的平衡常数K= (用只含a、V的式子表示)
②判断该反应达到平衡的标志是____(填序号)
A.v(CO2)生成=v(CO)消耗
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.NO、CO、N2、CO2的物质的量浓度均不再变化
(4)在一定温度下,将2.0molNO、2.4molCO通入固定容积2L的密闭中,反应过程中部分物质的物质的量变化如图所示,则: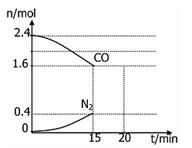
①有害气体NO的转化率是 ,0~15minCO2的平均反应速率v(CO2)=____(保留小数点后三位)
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件是 。(填序号)。
A.增加CO的量 B.加入催化剂
C.减小CO2的量 D.扩大容器体积
(共16分)Ⅰ.CO和H2作为重要的燃料和化工原料,有着十分广泛的应用。
(1)已知:C(s)+O2(g)=CO2(g) △H1= -393.5 kJ·mol-1
C(s)+H2O(g)= CO(g)+H2(g) △H2= +131.3 kJ·mol-1
则反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)△H= kJ·mol-1。
(2)利用反应CO(g) +H2(g)+O2(g) = CO2(g) +H2O(g) 设计而成的MCFS燃料电池是用水煤气(CO和H2物质的量之比为1:1)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质的一种新型电池。现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,反应装置以及现象如图所示。则有:

①燃料电池即电源的N极的电极反应式为 _______________________ ;
②已知饱和食盐水的体积为1 L,一段时间后,测得左侧试管中气体体积为11.2 mL(标准状况),若电解前后溶液的体积变化忽略不计,而且电解后将溶液混合均匀,则此时溶液的pH为 。
Ⅱ.CO和NO是汽车尾气的主要污染物。消除汽车尾气的反应式之一为:
2NO(g)+2CO(g)  N2(g)+2CO2(g)。请回答下列问题:
N2(g)+2CO2(g)。请回答下列问题:
(3)一定温度下,在一体积为VL的密闭容器中充人一定量的NO和CO时,反应进行到t时刻时达到平衡状态,此时n(CO)=amol、n(N0)=2amol、n(N2)=bmol,且N2占平衡混合气体总体积的1/4。
①该反应的平衡常数K= (用只含a、V的式子表示)
②判断该反应达到平衡的标志是____(填序号)
A.v(CO2)生成=v(CO)消耗
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.NO、CO、N2、CO2的物质的量浓度均不再变化
(4)在一定温度下,将2.0molNO、2.4molCO通入固定容积2L的密闭中,反应过程中部分物质的物质的量变化如图所示,则:

①有害气体NO的转化率是 ,0~15minCO2的平均反应速率v(CO2)=____(保留小数点后三位)。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件是 。(填序号)。
A.增加CO的量 B.加入催化剂
C.减小CO2的量 D.扩大容器体积
硫元素有多种化合价,可形成多种化合物。
(1)常温下用1mol•L-1 100 mL NaOH溶液恰好完全吸收0.1mol SO2气体,此反应的离子方程式为 ;该溶液pH<7的原因是 (结合方程式回答)。以石墨作电极,电解该物质的饱和溶液时,只有一个电极产生气体,写出阳极的电极反应式 。
(2)请按照浓度由大到小的顺序排列0.1mol/LNa2SO3溶液中的离子 。Na2SO3溶液放置于空气中一段时间后,溶液的pH (填“增大”“减小”或 “不变”)。
(3)某同学在常温下设计如下实验流程探究Na2S2O3的化学性质。
实验①可说明 (填字母)
| A.该Na2S2O3溶液中水电离的c(OH—)=10—8mol/L |
| B.H2S2O3是一种弱酸 |
| C.Na2S2O3是一种弱电解质 |
D.Na2S2O3水解方程式为S2O32—+2H2O H2S2O3+2OH— H2S2O3+2OH— |
写出实验②发生反应的离子方程式 。
(4)实验室制得的Na2S2O3粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。
称取1.28 g的粗样品溶于水,用0.40mol/L KMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32—全部被氧化时,消耗KMnO4溶液体积20.00 mL。
5S2O32—+8MnO4—+14H+ =8Mn2++10SO42—+7H2O)。试回答:
①此滴定实验是否需要指示剂 (填“是”或“否”),KMnO4溶液置于 (填“酸式”或“碱式”)滴定管中。
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果 (填“偏高”“偏低”或“不变”)。
③产品中Na2S2O3·5H2O的质量分数为 。(Na2S2O3·5H2O式量:248)(保留小数点后两位数)
钒是一种重要的合金元素,还用于催化剂和新型电池。从含钒固体废弃物(含有SiO2、Al2O3及其他残渣)中提取钒的一种新工艺主要流程如下: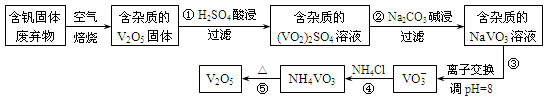
部分含钒化合物在水中的溶解性如下表:
| 物质 |
V2O5 |
NH4VO3 |
VOSO4 |
(VO2)2SO4 |
| 溶解性 |
难溶 |
难溶 |
可溶 |
易溶 |
部分含钒化合物在水中的溶解性如下表:
请回答下列问题:
(1)反应①所得溶液中除H+之外的阳离子有___________。
(2)反应②碱浸后滤出的固体主要成分是 (写化学式)。
(3)反应④的离子方程式为 。
(4)25℃、101 kPa时,4Al(s)+3O2(g)==2Al2O3(s) ΔH1=-a kJ/mol
4V(s)+5O2(g)==2V2O5(s) ΔH2=-b kJ/mol
用V2O5发生铝热反应冶炼金属钒的热化学方程式是 。
(5)钒液流电池(如图所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过。电池放电时负极的电极反应式为 ,电池充电时阳极的电极反应式是 。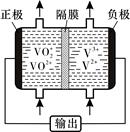
(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2VO2++H2C2O4+2H+===2VO2++2CO2↑+2H2O。取25.00 mL 0.1000 mol/L H2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0 mL,由此可知,该(VO2)2SO4溶液中钒的含量为 g/L。
H2O2是一种常用绿色氧化剂,在化学研究中应用广泛。
(1)空气阴极法电解制备H2O2的装置如下图所示,主要原理是在碱性电解质溶液中,通过利用空气中氧气在阴极还原得到H2O2和稀碱的混合物。试回答:

①直流电源的a极名称是 。
②阴极电极反应式为 。
③1979年,科学家们用CO、O2和水在三苯膦钯的催化下室温制得了H2O2。相对于电解法,该方法具有的优点是安全、 。
(2)Fe3+对H2O2的分解具有催化作用。利用图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的 (填“深”或“浅”),其原因是 。

(3)用H2O2和H2SO4的混合溶液可溶解印刷电路板金属粉末中的铜。反应的离子方程式是 ,控制其它条件相同,印刷电路板的金属粉末用10%H2O2 和3.0mol·L-1H2SO4溶液处理,测得不同温度下铜的平均溶解速率(见下表)
| 温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
| Cu的平均溶解速率 (×10-3mol·min-1) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是 。
(14分)铬(Cr)是周期表中VIB族元素,化合价可以是 0 ~+6 的整数价态。回答下列问题:
(1)某铬化合物的化学式为 Na3CrO8,其阴离子结构可表示为 ,则Cr的化合价为 。
,则Cr的化合价为 。
(2)在如图装置中,观察到Cu电极上产生大量的无色气泡,Cr电极周围出现天蓝色(Cr2+) ,而后又变成绿色 (Cr3+)。该电池总反应的过程表示为: ,2Cr2++2H+= 2Cr3++ H2。左侧烧杯溶液中c(Cl-) (填“增大”,“减小”或“不变”)。
(3)已知Ksp(BaCrO4)=1.2×10-10, Ksp(PbCrO4)= 2.8×10-13, Ksp(Ag2CrO4)= 2.0×10-12。某溶液中含有Ba2+、Pb2+、Ag+,浓度均为0.01 mol/L ,向该溶液中逐滴入 0.01 mol/L Na2CrO4溶液时,三种阳离子产生沉淀的先后顺序为 。
(4)在溶液中存在如下平衡:
则反应 的平衡常数K= 。
的平衡常数K= 。
(5)CrO2-4呈四面体构型,结构为 。CrO2-7由两个CrO2-4四面体组成,这两个CrO2-4四面体通过共用一个顶角氧原子彼连,结构为
。CrO2-7由两个CrO2-4四面体组成,这两个CrO2-4四面体通过共用一个顶角氧原子彼连,结构为 。则由n(n>1)个CrO2-4通过角顶氧原子连续的链式结构的化学式为 。
。则由n(n>1)个CrO2-4通过角顶氧原子连续的链式结构的化学式为 。
(6)CrO3是H2CrO4的酸酐,受热易分解。把一定量的 CrO3加热至790K时,残留固体的质量为原固体质量 76%。写出 CrO3受热分解化学方程式: 。
镁是海水中含量较多的金属,镁合金及其镁的化合物用途非常广泛。
(1)“镁-次氯酸盐”燃料电池的装置如下图所示: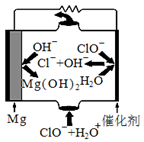
该电池的正极反应式为 。
(2)Mg2Ni是一种储氢合金,已知:
Mg(s) + H2(g)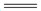 MgH2(s) △H1=-74.5kJ·mol-1
MgH2(s) △H1=-74.5kJ·mol-1
Mg2Ni(s) + 2H2(g)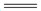 Mg2NiH4(s) △H2=-64.4kJ·mol-1
Mg2NiH4(s) △H2=-64.4kJ·mol-1
Mg2Ni(s)+2MgH2(s) 2Mg(s)+Mg2NiH4(s)的△H3= 。
2Mg(s)+Mg2NiH4(s)的△H3= 。
(3)一种用水氯镁石(主要成分为MgCl2·6H2O)制备金属镁工艺的关键流程如下: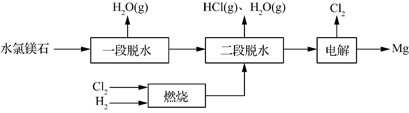
①为探究MgCl2•6H2O“一段脱水”的合理温度范围,某科研小组将MgCl2•6H2O在不同温度下分解,测得残留固体物质的X-射线衍射谱图如下图所示(X-射线衍射可用于判断某晶态物质是否存在)。
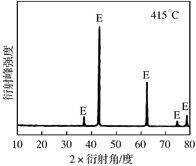
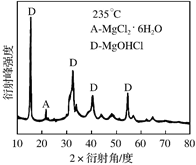
测得E中Mg元素质量分数为60.0%,则E的化学式为 。
②若电解时电解槽中有水分,则生成的MgOHCl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率。生成MgO的化学方程式为 。
(4)储氢材料Mg(AlH4)2在110~200°C的反应为:Mg(AlH4)2 MgH2 +2A1+3H2↑每生成27gAl转移电子的物质的量为_______________。
MgH2 +2A1+3H2↑每生成27gAl转移电子的物质的量为_______________。
二氧化碳被认为是加剧温室效应的主要来源。2014年11月12日中美两国在北
京发表《中美气候变化联合声明》,中国政府承诺到2030年前停止增加二氧化碳排放,
为此政府大力推广二氧化碳的综合开发和利用。以CO2和NH3为原料合成尿素是固定和
利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g) NH2CO2NH4(s) △H1 =" a" kJ·mol-1
NH2CO2NH4(s) △H1 =" a" kJ·mol-1
反应Ⅱ:NH2CO2NH4(s) CO(NH2)2(s)+H2O(g) △H2 =+72.49kJ·mol-1
CO(NH2)2(s)+H2O(g) △H2 =+72.49kJ·mol-1
总反应Ⅲ:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) △H3 =-86.98kJ·mol-1
CO(NH2)2(s)+H2O(g) △H3 =-86.98kJ·mol-1
请回答下列问题:
(1)反应Ⅰ的△H1 =__________kJ·mol-1(用具体数据表示)。
(2)反应Ⅲ中影响CO2平衡转化率的因素很多,图1为某特定条件下,不同水碳比n(H2O)/n(CO2)和温度影响CO2平衡转化率变化的趋势曲线。
①其他条件相同时,为提高CO2的平衡转化率,生产中可以采取的措施是_________(填“提高”或“降低”)水碳比。
②当温度高于190℃后,CO2平衡转化率出现如图1所示的变化趋势,其原因是__________________。
(3)反应Ⅰ的平衡常数表达式K1 =____________________。
(4)某研究小组为探究反应Ⅰ中影响c(CO2)的因素,在恒温下将0.4molNH3和0.2molCO2放入容积为2L的密闭容器中,从反应开始到达到平衡过程中c(CO2)随时间t变化趋势的曲线如图2所示。若其他条件不变,t1时将容器体积压缩到1L,请画出t1后c(CO2)随时间t变化趋势曲线(t2达到新的平衡)。
(5)尿素在土壤中会发生反应CO(NH2)2+2H2O (NH4)2CO3。下列物质中与尿素有类似性质的是______。
(NH4)2CO3。下列物质中与尿素有类似性质的是______。
| A.NH2COONH4 |
| B.H2NOCCH2CH2CONH2 |
| C.HOCH2CH2OH |
| D.HOCH2CH2NH2 |
(6)人工肾脏可用间接电化学方法除去代谢产物中的尿素,原理如图3。阳极室中发生的反应为 、 。