汽车尾气中的主要污染物是NO和CO。为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1)2NO(g)+2CO(g) 2CO2(g)+N2(g) △H=-746.5KJ/mol (条件为使用催化剂)
2CO2(g)+N2(g) △H=-746.5KJ/mol (条件为使用催化剂)
已知:2C (s)+O2(g) 2CO(g) △H=-221.0KJ/mol
2CO(g) △H=-221.0KJ/mol
C (s)+O2(g) CO2(g) △H=-393.5KJ/mol
CO2(g) △H=-393.5KJ/mol
则N2(g)+O2(g)=2NO(g) △H= kJ·mol-1。
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| C(NO)10-4 mol/L |
10.0 |
4.50 |
C1 |
1.50 |
1.00 |
1.00 |
| C(NO)10-3 mol/L |
3.60 |
3.05 |
C2 |
2.75 |
2.70 |
2.70 |
则c1合理的数值为 (填字母标号)。
A.4.20 B.4.00 C.3.50 D.2.50
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率。根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如下图所示:
则曲线Ⅰ对应的实验编号依次为 。
(4)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| H2O |
CO |
CO |
H2 |
|||
| ① |
650 |
2 |
4 |
2.4 |
1.6 |
5 |
| ② |
900 |
1 |
2 |
1.6 |
0.4 |
3 |
| ③ |
900 |
a |
b |
c |
d |
t |
①实验组①中以v(CO2)表示的反应速率为 ,温度升高时平衡常数会 (填“增大”、“减小”或“不变”)。
②若a=2,b=1,则c= ,达平衡时实验组②中H2O(g)和实验组③中CO的转化率的关系为
α2 (H2O) α3 (CO)(填“<”、“>”或“=”)。
(5)CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-。
①则负极的电极反应式为________________。
②以上述电池为电源,通过导线连接成图一。若X、Y为石墨,a为2L 0.1mol/L KCl溶液,写出电解总反应的离子方程式 。电解一段时间后,取25mL上述电解后的溶液,滴加0.4mol/L醋酸得到图二曲线(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。根据图二计算,上述电解过程中消耗一氧化碳的质量为__________g。

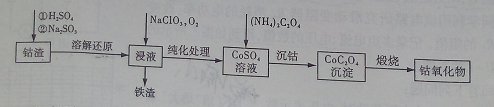
 2HX(g) (X2表示Cl2、Br2和I2)。
2HX(g) (X2表示Cl2、Br2和I2)。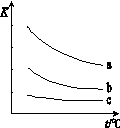


 MnSO4(aq)+2CO2(g)+2H2O(1) △H
MnSO4(aq)+2CO2(g)+2H2O(1) △H
 WI2(g)。该反应在石英真空管中进行,如下图所示:
WI2(g)。该反应在石英真空管中进行,如下图所示: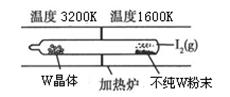
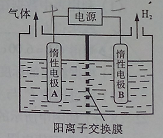
 CH3CH2OH+CH3COOH,实验室中,以一定浓度的乙醛和Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。
CH3CH2OH+CH3COOH,实验室中,以一定浓度的乙醛和Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号