镁是海水中含量较多的金属,镁合金及其镁的化合物用途非常广泛。
(1)“镁-次氯酸盐”燃料电池的装置如下图所示: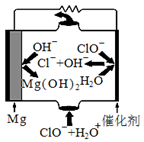
该电池的正极反应式为 。
(2)Mg2Ni是一种储氢合金,已知:
Mg(s) + H2(g)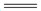 MgH2(s) △H1=-74.5kJ·mol-1
MgH2(s) △H1=-74.5kJ·mol-1
Mg2Ni(s) + 2H2(g)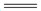 Mg2NiH4(s) △H2=-64.4kJ·mol-1
Mg2NiH4(s) △H2=-64.4kJ·mol-1
Mg2Ni(s)+2MgH2(s)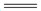 2Mg(s)+Mg2NiH4(s)的△H3= 。
2Mg(s)+Mg2NiH4(s)的△H3= 。
(3)一种用水氯镁石(主要成分为MgCl2·6H2O)制备金属镁工艺的关键流程如下: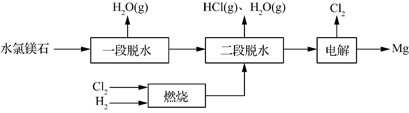
①为探究MgCl2•6H2O“一段脱水”的合理温度范围,某科研小组将MgCl2•6H2O在不同温度下分解,测得残留固体物质的X-射线衍射谱图如下图所示(X-射线衍射可用于判断某晶态物质是否存在)。
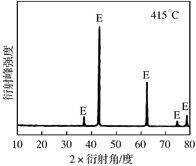
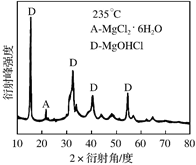
测得E中Mg元素质量分数为60.0%,则E的化学式为 。
②若电解时电解槽中有水分,则生成的MgOHCl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率。生成MgO的化学方程式为 。
(4)储氢材料Mg(AlH4)2在110~200°C的反应为:Mg(AlH4)2 MgH2 +2A1+3H2↑每生成27gAl转移电子的物质的量为_______________。
MgH2 +2A1+3H2↑每生成27gAl转移电子的物质的量为_______________。
(15分)四川省钙芒硝矿(主要成分CaSO4•Na2SO4)资源丰富。钙芒硝矿可生产具有广泛用途的芒硝(Na2SO4•10H2O)和元明粉(Na2SO4),其简要生产流程如下图所示。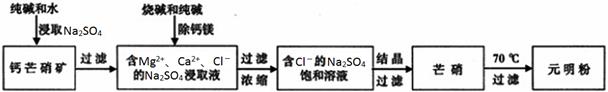
请回答下列问题:
(1)浸取Na2SO4时,加入少量Na2CO3可使钙芒硝矿中的部分CaSO4转化为CaCO3,破坏钙芒硝矿结构,从而促进Na2SO4的浸取。CaSO4能转化为CaCO3的原因是_________________________。
(2)向Na2SO4的浸取液中加入适量烧碱和纯碱,Ca2+和Mg2+分别生成①________、②_________(填化学式)被过滤除去。
(3)根据下图溶解度曲线,可采用冷却结晶法从含少量NaCl的Na2SO4饱和溶液中制得芒硝的原因是___________________________________________________________________________。
(4)已知:25℃、101kPa时,
2C(s) + O2(g) ="=" 2CO(g) ΔH1 = —222kJ/mol
4Na2SO3(s) ="=" 3Na2SO4(s) + Na2S(s) ΔH2 = —122kJ/mol
2Na2SO3(s) + O2(g) ="=" 2Na2SO4(s) ΔH 3= —572kJ/mol
元明粉经碳还原制备Na2S的热化学方程式是__________________________________________________。
(5)如图,用惰性电极电解Na2SO4溶液,阳极区制得H2SO4溶液,阴极区制得NaOH溶液。其电解总反应的化学方程式是:______________________________。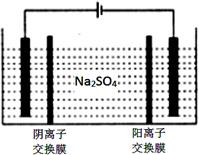
(6)芒硝加热至70℃时,得到Na2SO4的饱和溶液(结晶水作溶剂,忽略加热过程中水的蒸发)和无水Na2SO4。若3220kg芒硝加热至70℃时,可析出元明粉(Na2SO4)的质量是________kg。
铬是用途广泛的金属元素,但在生产过程中易产生有害的含铬工业废水。
(1)还原沉淀法是处理含Cr2O72—和CrO42—工业废水的一种常用方法,其工艺流程为:
其中第I步存在平衡:2CrO42—(黄色)+2H+ Cr2O72— (橙色)+H2O
Cr2O72— (橙色)+H2O
①若平衡体系的pH=2,该溶液显 色。
②根据2CrO42—+2H+ Cr2O72— +H2O,设计下图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7。Na2Cr2O7中铬元素的化合价为 ,图中右侧电极连接电源的 极,其电极反应式为 。
Cr2O72— +H2O,设计下图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7。Na2Cr2O7中铬元素的化合价为 ,图中右侧电极连接电源的 极,其电极反应式为 。
③第Ⅱ步反应的离子方程式: ,向Ⅱ反应后的溶液加一定量NaOH,若溶液中c(Fe3+)=2.0×10—12mol·L—1,则溶液中c(Cr3+)= mol·L—1。(已知Ksp[Fe(OH)3]=4.0×10—38,Ksp[Cr(OH)3]=6.0x10—31)。
(2)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火。若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的Cr2(SO4)3。完成该反应的化学方程式:
(3)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示。B点时剩余固体的成分是 (填化学式)。
(14分)苯乙烯(C6H5CH=CH2)是合成橡胶和塑料的单体,用来生产丁苯橡胶、聚苯乙烯等。工业上以乙苯(C6H5CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯,反应方程式为:
C6H5CH2CH3(g)  C6H5CH=CH2(g)+H2(g)
C6H5CH=CH2(g)+H2(g)  H
H
(1)已知:H2和CO的燃烧热( H)分别为-285.8 kJ.mol
H)分别为-285.8 kJ.mol 和-283.0 kJ.mol
和-283.0 kJ.mol ;
;
C6H5CH2CH3(g)+CO2 (g) C6H5CH=CH2(g)+CO(g)+H2O(l)
C6H5CH=CH2(g)+CO(g)+H2O(l)  H=+114.8 kJ·mol-1
H=+114.8 kJ·mol-1
则制取苯乙烯反应的 H为_________
H为_________
(2)向密闭容器中加入1 mol乙苯,在恒温恒容条件下合成苯乙烯,达平衡时,反应的能量变化为QkJ。下列说法正确的是 _________。
| A.升高温度,正反应速率减小,逆反应速率增大 |
| B.若继续加入1 mol乙苯,苯乙烯转化率增大 |
| C.压缩体积,平衡逆向移动,反应物浓度增大,生成物浓度减小 |
| D.相同条件下若起始加入1 mol苯乙烯和1 mol氢气, |
达平衡时反应能量变化为( H-Q)kJ
H-Q)kJ
(3)向2 L密闭容器中加入1 mol乙苯发生反应,达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示。700 时,乙苯的平衡转化率为_______,此温度下该反应的平衡常数为 ______;温度高于970
时,乙苯的平衡转化率为_______,此温度下该反应的平衡常数为 ______;温度高于970 时,苯乙烯的产率不再增加,其原因可能是_________。
时,苯乙烯的产率不再增加,其原因可能是_________。
(4)含苯乙烯的废水排放会对环境造成严重污染,可采用电解法去除废水中的苯乙烯,基本原理是在阳极材料MOx上生成自由基MOx(OH),其进一步氧化有机物生成CO2,该阳极的电极反应式为_________,若去除0.5 mol苯乙烯,两极共收集气体_________mol。
二氧化碳是引起“温室效应”的主要物质,节能减排、高效利用能源能够减少二氧化碳的排放。
(1)在一定温度下的2L固定容积的密闭容器中,通入2 mol CO2和3mol H2,发生的反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-a kJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) △H=-a kJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。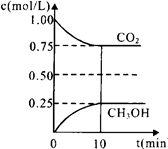
①能说明该反应已达平衡状态的是______ __。
A.CO2的体积分数在混合气体中保持不变
B.混合气体的密度不随时间的变化而变化。
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O。 D.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变。
D.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变。
②下列措施中能使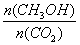 增大的是________(选填编号)。
增大的是________(选填编号)。
A.升高温度
B.恒温恒容下充入He(g) C.将H2O(g)从体系中分离
C.将H2O(g)从体系中分离
D.恒温恒容再充入2 mol CO2和3 mol H2
③计算该温度下此反应的平衡常数K=__________。若改变条件(填选项),可使K=1。
A.增大压强
B.增大反应物浓度
C.降低温度
D.升高温度
E.加入催化剂
(2)某甲醇燃料电池原理如下图1所示。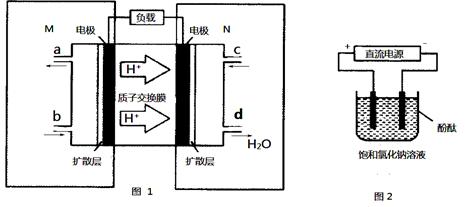
①M区发生反应的电极反应式为_______________________________。
②用上述电池做电源,用上图2装置电解饱和食盐水(电极均为惰性电极),则该电解反应的总反应的离子方程式为________________________。假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________(忽略溶液体积变化)。
硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用方铅矿精矿(PbS)直接制备硫酸铅粉末的流程如下: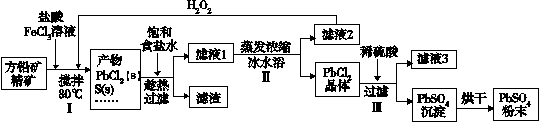
已知:(ⅰ)PbCl2(s)+2Cl-(aq) PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
(ⅱ)有关物质的Ksp和沉淀时的pH如下:
| Ksp |
|
开始沉淀时pH |
完全沉淀时pH |
|
| PbSO4 |
1.08×10-8 |
Fe (OH)3 |
2.7 |
3.7 |
| PbCl2 |
1.6×10-5 |
Pb(OH)2 |
6 |
7.04 |
(1)步骤Ⅰ中生成PbCl2的离子方程式_______,加入盐酸控制pH值小于2,原因是_______。
(2)用化学平衡移动原理解释步骤Ⅱ中使用冰水浴的原因______。若原料中FeCl3过量,则步骤Ⅱ得到的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是_______。
(3)写出步骤Ⅲ中PbCl2晶体转化为PbSO4沉淀的离子方程式______。
(4)请用离子方程式解释滤液2加入H2O2可循环利用的原因______。
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为_______。
(6)双隔膜电解池的结构示意简图如图所示,利用铅蓄电池电解硫酸钠溶液可以制取硫酸和氢氧化钠,并得到氢气和氧气。对该装置及其原理判断正确的是____。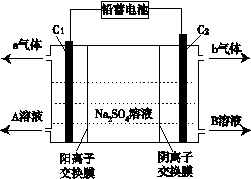
A.A溶液为氢氧化钠,B溶液为硫酸
B.C1极与铅蓄电池的PbO2电极相接、C2极与铅蓄电池的Pb电极相接
C.当C1极产生标准状况下11.2 L气体时,铅蓄电池的负极增重49g
D.该电解反应的总方程式可以表示为:2Na2SO4+6H2O 2H2SO4+4NaOH+O2↑+2H2↑
2H2SO4+4NaOH+O2↑+2H2↑
工业废水中常含有一定量的Cr2O,会对人类及生态系统产生很大损害,电解法是行之有效的除去铬的方法之一。该法用Fe和石墨作电极电解含Cr2O 的酸性废水,最终将铬转化为Cr(OH)3沉淀,达到净化目的。某科研小组利用以上方法处理污水,设计了熔融盐电池和污水电解装置如下图所示。
的酸性废水,最终将铬转化为Cr(OH)3沉淀,达到净化目的。某科研小组利用以上方法处理污水,设计了熔融盐电池和污水电解装置如下图所示。
(1)Fe电极为 (填“M”或“N”);电解时 (填“能”或“不能”)否用Cu电极来代替Fe电极,理由是 。
(2)阳极附近溶液中,发生反应的离子方程式是
阴极附近的沉淀有 。
(3)图中熔融盐燃料电池是以熔融碳酸盐为电解质、CH4为燃料、空气为氧化剂、稀土金属材料为电极的新型电池。已知,该熔融盐电池的负极的电极反应是CH4–8e–+4CO32–==5CO2+2H2O,则正极的电极反应式为 。
(4)实验过程中,若电解池阴极材料质量不变,产生4.48L(标准状况)气体时,熔融盐燃料电池消耗CH4的体积为 L(标准状况)。
(15分)利用LiOH和钴氧化物可制备锂离子电池正极材料。LiOH可由电解法制备,钴氧化物可通过处理钴渣获得。
(1)利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。B极区电解液为__________溶液(填化学式),阳极电极反应式为__________ ,电解过程中Li+向_____电极迁移(填“A”或“B”)。
(2)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:
Co(OH)3溶解还原反应的离子方程式为____________________________________,铁渣中铁元素的化合价为___________,在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为__________。
化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”提纯金属钨的反应原理为W(s)+I2(g) WI2(g)。该反应在石英真空管中进行,如下图所示:
WI2(g)。该反应在石英真空管中进行,如下图所示:
①该反应的平衡常数表达式K=_______,若K=1/2,向某恒容密闭容器中加入1mol I2(g)和足量W(s),反应达到平衡时I2(g)的转化率为__________。
②该反应的△H____0(填“>”或“<”),上述反应体系中可循环使用的物质____。
③能够说明上述反应已经达到平衡状态的有_________(填序号)。
a.I2与WI2的浓度相等
b.W的质量不再变化
c.容器内混合气体的密度保持不变
d.单位时间内,金属钨消耗的物质的量与碘化钨生成的物质的量相等
(2)利用“隔膜电解法”处理高浓度乙醛废水的工艺具有流程简单、能耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应生成乙醇和乙酸,总反应式为2CH3CHO+H2O CH3CH2OH+CH3COOH,实验室中,以一定浓度的乙醛和Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。
CH3CH2OH+CH3COOH,实验室中,以一定浓度的乙醛和Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。
①若以甲烷碱性燃料电池为直流电源,则燃料电池中b极应通入__________(填化学式)。
②电解池阳极区的电极反应式为_________________。
③在实际工艺处理中,阴极区乙醛的去除率可达60%。若在两极区分别注入1 m3乙醛含量为3000 mg·L-1的废水,可得到乙醇________kg(计算结果保留小数点后一位)。
二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
(1)有一种用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-b kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-c kJ·mol-1;
H2O(g)=H2O(l) △H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:_____________________________。
(2)在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生的反应为:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-a kJ/mol(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g)△H=-a kJ/mol(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
①能说明该反应已达平衡状态的是________。(选填编号)
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D.该体系中H2O与CH3OH的物质的量浓度之比为1:1,且
保持不变
②计算该温度下此反应的平衡常数K=_______。(保留两位有效数字)。若改变条件 (填选项),可使K=1。
A.增大压强
B.增大反应物浓度
C.降低温度
D.升高温度
E.加入催化剂
(3)某甲醇燃料电池原理如图1所示。
①M区发生反应的电极反应式为_______________________________。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),则该电解的总反应离子方程式为: 。假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________(忽略溶液体积变化)。
(1)在某一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)
 2C(g) ΔH < 0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是 (填序号字母)
2C(g) ΔH < 0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是 (填序号字母)
a.0~t1时,v正>v逆 ,t2时,v逆>v正
b.混合气体的密度不再改变时,Ⅰ、Ⅱ两过程达到平衡
c.t2时刻改变的条件可以是向密闭容器中加C
d.Ⅰ、Ⅱ两过程达到平衡时,平衡常数Ⅰ<Ⅱ
(2)工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2]。
t℃时,向容积恒定为2L的密闭容器中加入0.10 molCO2和0. 40 molNH3,70 min开始达到平衡。反应中CO2 ( g)的物质的量随时间变化如下表所示:
| 时间/min |
0 |
20 |
70 |
80 |
100 |
| n(CO2) /mol |
0.10 |
0.060 |
0.020 |
0.020 |
0.020 |
①20 min时,平均反应速率υ (CO2 )= mol/L·min。
②在100 min时,保持其它条件不变,再向容器中充入0. 050 mo1CO2和0. 20 molNH3,重新建立平衡后CO2的转化率与原平衡相比将 (填“增大”、“不变”或“减小”)。
③上述可逆反应的平衡常数为_ (保留一位小数)。
④下图所示装置(阴、阳极均为惰性电极)可用于电解尿素〔CO(NH2)2〕的碱性溶液制取氢气。该装置中阳极的电极反应式为 ,
(3)CH4燃料电池,装置示意如图(A、B为多孔性碳棒)。持续通入甲烷,在标准状况下,消耗甲烷体积VL。当 V="44.8" L时,电池总反应方程式为 ;用该电池为电源,以石墨作电极,电解上述实验分离出的溶液,两极均产生气泡。持续电解,在阴极附近的溶液中还可观察到的现象是________________。
I.将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,各物质浓度随时间变化的关系如图1所示。
请回答:
(1)下列选项中不能说明该反应已达到平衡状态的是 (填选项字母)。
| A.容器内混合气体的压强不随时间变化而改变 |
| B.容器内混合气体的密度不随时间变化而改变 |
| C.容器内混合气体的颜色不随时间变化而改变 |
| D.容器内混合气体的平均相对分子质量不随时间变化而改变 |
(2)反应进行到10 min时,共吸收热量11.38 kJ,则该反应的热化学方程式为 ;
(3)计算该反应的平衡常数K= 。
(4)反应进行到20 min时,再向容器内充入一定量NO2,10min后达到新的平衡,此时测得c(NO2)=0.9 mol/L。
①第一次平衡时混合气体中NO2的体积分数为w1,达到新平衡后混合气体中NO2的体积分数为w2,则w1 w2 (填“>”、“=”或“<”);
②请在图2中画出20 min后各物质的浓度随时间变化的曲线(曲线上必须标出“X”和“Y”)。
II.(1)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料。如LiFePO4电池中某电极的工作原理如下图所示:
该电池的电解质为能传导Li+的固体材料。放电时该电极是电池的 极(填“正”或“负”),该电极反应式为 。
(2)用此电池电解含有0.1 mol/L CuSO4和0.1 mol/L NaCl的混合溶液100 mL,假如电路中转移了0.02 mol e-,且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是__________L。
汽车尾气中的主要污染物是NO和CO。为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1)2NO(g)+2CO(g) 2CO2(g)+N2(g) △H=-746.5KJ/mol (条件为使用催化剂)
2CO2(g)+N2(g) △H=-746.5KJ/mol (条件为使用催化剂)
已知:2C (s)+O2(g) 2CO(g) △H=-221.0KJ/mol
2CO(g) △H=-221.0KJ/mol
C (s)+O2(g) CO2(g) △H=-393.5KJ/mol
CO2(g) △H=-393.5KJ/mol
则N2(g)+O2(g)=2NO(g) △H= kJ·mol-1。
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| C(NO)10-4 mol/L |
10.0 |
4.50 |
C1 |
1.50 |
1.00 |
1.00 |
| C(NO)10-3 mol/L |
3.60 |
3.05 |
C2 |
2.75 |
2.70 |
2.70 |
则c1合理的数值为 (填字母标号)。
A.4.20 B.4.00 C.3.50 D.2.50
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率。根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如下图所示:
则曲线Ⅰ对应的实验编号依次为 。
(4)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| H2O |
CO |
CO |
H2 |
|||
| ① |
650 |
2 |
4 |
2.4 |
1.6 |
5 |
| ② |
900 |
1 |
2 |
1.6 |
0.4 |
3 |
| ③ |
900 |
a |
b |
c |
d |
t |
①实验组①中以v(CO2)表示的反应速率为 ,温度升高时平衡常数会 (填“增大”、“减小”或“不变”)。
②若a=2,b=1,则c= ,达平衡时实验组②中H2O(g)和实验组③中CO的转化率的关系为
α2 (H2O) α3 (CO)(填“<”、“>”或“=”)。
(5)CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-。
①则负极的电极反应式为________________。
②以上述电池为电源,通过导线连接成图一。若X、Y为石墨,a为2L 0.1mol/L KCl溶液,写出电解总反应的离子方程式 。电解一段时间后,取25mL上述电解后的溶液,滴加0.4mol/L醋酸得到图二曲线(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。根据图二计算,上述电解过程中消耗一氧化碳的质量为__________g。
SO2、NO是大气污染物。吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
(1)装置Ⅰ中生成HSO3-的离子方程式为 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如图所示。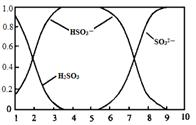
①下列说法正确的是 (填字母序号)。
a.pH=8时,溶液中c(HSO3-) < c(SO32-)
b.pH=7时,溶液中c(Na+) =c(HSO3-)+c(SO32-)
c.为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
(3)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,写出生成NO3-的离子方程式 。
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。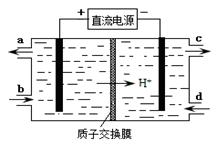
①生成Ce4+的电极反应式为 。
②生成Ce4+从电解槽的 (填字母序号)口流出。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L(用含a代数式表示,计算结果保留整数).
世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。实验室以电解法制备ClO2的流程如下:
已知:①NCl3是黄色黏稠状液体或斜方形晶体,极易爆炸,有类似氯气的刺激性气味,自然爆炸点为95℃,在热水中易分解,在空气中易挥发,不稳定。
②气体B能使湿润的红色石蕊试纸变蓝。
回答下列问题:
(1)电解时,发生反应的化学方程式为 。
实验室制备气体B的化学方程式为 ,为保证实验的安全,在电解时需注意的问题是:①控制好生成NCl3的浓度;② 。
(2)NCl3与NaClO2(亚氯酸钠)按物质的量之比为1∶6混合,在溶液中恰好反应生成ClO2,该反应的离子方程式为 。
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10 mL,稀释成100 mL试样;
步骤2:量取V1 mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30 min。
步骤3:以淀粉溶液作指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
(已知I2+2S2O32-=2I-+S4O62-)
①上述步骤3中滴定终点的现象是 ;
②根据上述步骤可计算出原ClO2溶液的浓度为 g /L(用含字母的代数式表示)。