高锰酸钾是强氧化剂,它的用途遍布各个行业。
(1)工业上由软锰矿(主要成分为MnO2)生产髙锰酸钾分为两个步骤:
①步骤一将软锰矿与过量的固体KOH和空气在高温下反应,生成锰酸钾(K2MnO4),该反应的化学方程式是 。
②步骤二以石墨为阳极,铁为阴极,电解锰酸钾(K2MnO4)溶液,在 (填“阴极区”或“阳极区”)得到高锰酸钾。阴极反应的电极反应式是 。
(2)某研究小组用工业生产高锰酸钾产生的废渣——锰泥(含K2MnO4、MnO2及Pb、Ca等元素)和乳钢废酸液制取工业级碳酸锰(MnCO3),其流程如下:
③轧钢废酸中Fe2+的作用是 。
④操作I、操作Ⅱ、操作Ⅲ的名称是 。
⑤溶液C中除含有Ca2+、Mn2+、H+外,还含有的阳离子是 。
⑥若固体C中不含CaCO3,则溶液C中 < (已知:Ksp(MnCO3)=1×10-11,Ksp(CaCO3)=5×10-9)。
< (已知:Ksp(MnCO3)=1×10-11,Ksp(CaCO3)=5×10-9)。
如图,用惰性电极电解由四种都为元素周期表原子序数前10号元素组成的A溶液,在两电极区域分别得到B、C、D、E四种气体。它们之间在一定条件下反应流程如图所示。其中F、D中原子核外电子总数相等,E是常见的导致温室效应的气体。常温下,在F中先通足量E气体,再通足量D气体,生成一种与A元素组成相同的物质G。上述反应流程没有其他物质参与。


(1)写出G中的化学键类型 ,E的电子式 。
(2)写出上述反应流程中生成A的离子反应方程式 。
(3)写出D在纯净C中燃烧的化学反应方程式 。
(4)通常情况下,D极易溶于F中,其原因 。
(5)往G的饱和溶液中通入E也能制得A,写出该反应的化学方程式 。
(6)写出该题中电解A溶液反应的总离子方程式 。
金属单质及其化合物在工农业生产中应用广泛。
(1)用FeC13溶液腐蚀印刷电路板上的铜,向所得溶液中加入铁粉。对加入铁粉充分反应后的溶液分析合理的是_______。
a.若无固体剩余,则溶液中可能有Fe3+
b.若有固体存在,则溶液中一定有Cu2+和Fe2+
c.若溶液中有Cu2+,则可能有固体存在,且该固体中一定没有铁粉
d.若溶液中有Fe2+,则一定有固体存在
(2)Cu2O是一种半导体材料,制取Cu2O的电解池如图,则石墨电极接电源的_______(填“正”或“负”)极,电解池工作时,Cu电极的电极反应式为______;电解后溶液pH______(填“变大”、“变小”或“不变”)
(3)查阅资料可知:Cu2O为红色碱性氧化物,在酸性溶液中可发生反应:Cu2O+2H+=Cu+Cu2++H2O。请设计简单实验来验证某铜粉样品中是否有氧化亚铜:_____。
硫的化合物在科研、生活及化学工业中具有重要的应用。
(1)在废水处理领域中,H2S或Na2S能使某些金属离子生成极难溶的硫化物而除去。25℃,在0.10 mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如下表(忽略溶液体积的变化、H2S的挥发)。
| pH |
3 |
5 |
7 |
9 |
11 |
| c(S2-)/ mol•L-1 |
1.4×10-15 |
1.4×10-11 |
6.8×10-8 |
1.3×10-5 |
1.3×10-3 |
某溶液含0.020 mol•L-1Mn2+、0.1 mol•L-1H2S,当溶液的pH=5时,Mn2+开始沉淀,则MnS的溶度积=________________。
(2)工业上采用高温分解H2S制取氢气,其反应为2H2S(g) 2H2(g)+S2(g) △H1,在膜反应器中分离出H2。
2H2(g)+S2(g) △H1,在膜反应器中分离出H2。
①已知:H2S(g) H2(g)+S(g) △H2,2S(g)
H2(g)+S(g) △H2,2S(g) S2(g)△H3。则△H1=_______(用含△H2、△H3的式子表示。
S2(g)△H3。则△H1=_______(用含△H2、△H3的式子表示。
②在密闭容器中,充入0.10molH2S(g),发生反应2H2S(g) 2H2(g)+S2(g),控制不同的温度和压强进行实验。结果如图所示。
2H2(g)+S2(g),控制不同的温度和压强进行实验。结果如图所示。
图中压强p1、p2、p3由大到小的顺序为_______________,理由是_________________。若容器的容积为2.0L,则压强为p3,温度为950℃时,反应经3h达到平衡,则达到平衡时v(S2)=__________;若压强p2=7.2MPa,温度为975℃时,该反应的平衡常数Kp=_____________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数),若保持压强不变,升温到1000℃时,则该反应的平衡常数___________(填“增大”“不变”或“减小”)。
(3)工业上用惰性电极电解KHSO4饱和溶液制取H2O2,示意图如图所示:
①低温电解饱和KHSO4溶液时阳极的电极反应式为_________________。
②K2S2O8水解时生成H2O2和KHSO4,该反应的化学方程式为_________________。
(12分)甲醇可作为燃料电池的原料。通过下列反应可以制备甲醇:CO ( g )+2H2 ( g )  CH3OH ( g )
CH3OH ( g )  H=-90.8 kJ·mol-1,在一容积可变的密闭容器中充入10 mol CO 和20 mol H2,CO 的 平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态B 时,容器的体积为4 L。
H=-90.8 kJ·mol-1,在一容积可变的密闭容器中充入10 mol CO 和20 mol H2,CO 的 平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态B 时,容器的体积为4 L。
(1)该反应的化学平衡常数表达式为 。
(2)如反应开始时仍充入10 mol CO 和20 mol H2,则在平衡状态A时,容器的体积V(A)= L。
(3)关于反应CO(g)+2H2(g) CH3OH(g)建立化学平衡状态时的标志是 (填字母)。
CH3OH(g)建立化学平衡状态时的标志是 (填字母)。
A.CO的含量保持不变
B.容器中CH3OH浓度与CO浓度相等
C.2V正(CH3OH)=V正(H2)
D.容器中混合气体的平均相对分子质量保持不变
(4)已知CO2(g)+H2(g) CO(g)+H2O(g) H=+41.3 kJ·mol-1,试写出由CO2和H2制取甲醇的热化学方程式 。
CO(g)+H2O(g) H=+41.3 kJ·mol-1,试写出由CO2和H2制取甲醇的热化学方程式 。
(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。
实验室用下图装置模拟上述过程:
①写出阳极的电极反应式______________ _。
②写出除去甲醇的离子方程式_______________ ___。
(1)对工业合成氨条件的探索一直是化学工业的重要课题,在恒温恒容的甲容器、恒温恒压的乙容器中分别进行合成氨反应,如下图(图中所示数据均为初始物理量)。t分钟后反应均达到平衡,生成的NH3均为0.4mol(忽略水对压强的影响及氨气的溶解)。

T=a℃ V=2L T=a℃ V=2L 移动活塞
①判断甲容器中的反应达平衡的依据是 。(填写相应编号)
| A.压强不随时间改变 |
| B.气体的密度不随时间改变 |
| C.c(N2)不随时间改变 |
| D.单位时间内生成2 mol NH3的同时消耗1 mol N2 |
E.单位时间内断裂3 mol H-H键,同时断裂6 mol N-H键
②该条件下甲容器中反应的平衡常数K= ;平衡时,甲的压强P平= (用初始压强P0表示)。
(2)最近华南理工大提出利用电解法制H2O2并用产生的H2O2处理废氨水,装置如图所示。

①为了不影响H2O2的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中c(NH4+)_________c(NO3-)(填“>”、“<”或“=”)。
②Ir-Ru惰性电极有吸附O2作用,该电极上的反应为 。
③理论上电路中每转移3 mol电子,最多可以处理NH3·H2O的物质的量为 。
铬元素及其化合物在生产、生活中具有广泛的用途。
(1)在常温下,铬能缓慢与稀硫酸反应,生成蓝色溶液。其金属性比铜 (填“强”或“弱”)。
(2)Cr(OH)3和Al(OH)3性质类似,则Cr(OH)3与KOH反应的离子方程式为 。
(3)工业上净化处理铬污染的可用电解法。将含K2Cr2O7酸性废水放入电解槽内,加入适量的NaCl,以Fe作阳极和石墨作阴极进行电解。经过一段时间后,溶液中Cr和Fe转化为Cr(OH)3和Fe(OH)3沉淀除去。
①写出阴极的电极反应式: 。
②溶液中Fe、Cr元素最终转化为Fe(OH)3和Cr(OH)3沉淀除去,原理为 (用离子方程式和必要的文字说明)。
③电解后的溶液中c(Fe3+)为2.0×10-13 mol·L-1,则溶液中c(Cr3+)为 mol·L-1
(已知Ksp[ Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×l0-31)。
(4)CrO3具有强氧化性,可用于查处酒驾,原理是在酸性条件下能将乙醇氧化成乙酸,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3],则该反应的化学方程式为 。
(5)CrO3的热稳定性较差,加热时逐步分解,其固体残留率( )随温度的变化如图所示,则B点时剩余固体的成分是____________(填化学式)。
)随温度的变化如图所示,则B点时剩余固体的成分是____________(填化学式)。
右图是一个化学过程的示意图。已知甲池的总反应式为:
2CH3OH+3O2+4KOH=2K2CO3+6H2O

(1)请回答图中甲、乙两池的名称。甲电池是 装置,乙池是 装置。
(2)请回答下列电极的名称:通入CH3OH的电极名称是 ,B(石墨)电极的名称是 。
(3)写出电极反应式:
通入O2的电极的电极反应式是 。
A(Fe)电极的电极反应式为 。
(4)乙池中反应的化学方程式为 。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2 mL(标准状况下)
铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各 种性能的不锈钢,CrO3 大量地用于电镀工业中。
(1)在下图装置中,观察到图 1 装置铜电极上产生大量的无色气泡,而图 2 装置中铜电 极上无气体产生,铬电极上产生大量有色气体。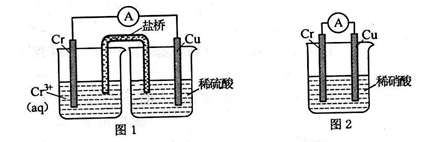
图 2 装置中铬电极的电极反应式______________________
(2)最近赣州酒驾检查特别严,利用 CrO3具有强氧化性,有机物(如酒精)遇到 CrO3时,猛烈反应,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3],另该过程中乙醇被氧化成乙酸, 从而增强导电性,根据电流大小可自动换算出酒精含量。写出该反应的化学方程式为_________________________
(3)虽然铬加到铁中可将铁做成不锈钢可减少金属腐蚀,但 生产成本高,生活中很多情况下还是直接使用钢铁,但易腐蚀, 利用右图装置,可以模拟铁的电化学防护。若 X 为碳棒,为 减缓铁的腐蚀,开关 K 应置于________处。若 X 为锌,开关K 置于________处。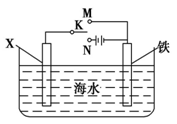
(4)CrO3 和 K2Cr2O7 均易溶于水,这是工业上造成铬污染的 主要原因。净化处理方法之一是将含+6 价 Cr 的废水放入电解槽内,用铁作阳极,加入 适量的 NaCl 进行电解:阳极区生成的 Fe2+和 Cr2O72-发生反应,生成的 Fe3+和 Cr3+在阴极 区与OH-结合生成 Fe(OH)3和 Cr(OH)3沉淀除去【已知某条件下的KspFe (OH)3 = 3.0×10-31, KspCr(OH)3 = 6.0×10-38】。已知电解后的溶液中 c(Fe3+)为 2.0×10-6 mol·L1,则溶液中c(Cr3+)为______________mol·L-1。
工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法。
(1)电池生产工业废水中常含有Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去。已知室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2。
①请用离子方程式说明上述除杂的原理______________________。
②FeS高温煅烧产生的SO2气体通入下列溶液中,能够产生沉淀的是_________(填序号)
A.Ba(NO3)2 B.BaCl2
C.Ba(OH)2 D.溶有NH3的BaCl2溶液
③已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是___________。
(2)电解法处理酸性含铬废水(主要含有Cr2O72-)时,在废水中加入适量NaCl,以铁板作阴、阳极,处理过程中存在如下反应Cr2O72+6Fe2++14H+═2Cr3++6Fe3++7H2O,最后Cr3+ 以Cr(OH)3形式除去,下列说法不正确的是______(填序号)
A.阳极反应为Fe-2e-═Fe2+
B.电解过程中溶液pH减小
C.过程中有Fe(OH)3沉淀生成
D.电路中每转移12 mol电子,最多有2mol Cr2O72-被还原
(3)废氨水可以转化成氨,氨再设计成碱性燃料电池。右图是该燃料电池示意图,产生的X气体可直接排放到大气中,a电极作_________极(填“正”“负”“阴”或“阳”),其电极反应式为___________。

I.炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红色锈斑。请回答:
写出铁锅腐蚀时正极的电极反应式: 。
II.氯碱工业中电解饱和食盐水的原理示意图如下图所示:

(1)溶液A的溶质是 ;
(2)电解饱和食盐水的离子方程式是 ;
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用平衡移动移动原理解释盐酸的作用: 。
Ⅲ.(1)按右图电解氯化钠的稀溶液可制得漂白液,写出该电解池中发生反应的总反应方程式: ;

(2)将充分电解后所得溶液逐滴加入到酚酞试液中,观察到的(3)现象是 。
如图所示的电解装置中,乙池盛有200mL饱和CuSO4溶液,丙池盛有200mL饱和NaCl溶液.通电一段时间后,C极增重0.64g,则:

(1)P是电源的_________极。甲池中,A极的质量_________g。电解一段时间,甲池溶液的pH为_________。(2)D极的电极反应式为 ,丙池电解反应的总离子方程式为 。
相同状况下,D电极与E电极产生的气体体积比为_______________。
(3)若乙池溶液通电一段时间后,向所得的溶液中加入0.1mol的Cu(OH)2后恰好恢复到电解前的浓度。则电解过程中转移电子的数目为__________________。(用NA表示)
NH4NO3主要用作肥料、军用炸药、冷冻剂、制造笑气等。
(1)铵态氮肥NH4NO3________(填“能”或“不能”)与草木灰混合施用,用盐类水解的知识简述原因__________。
(2)NH4NO3受热分解温度不同,分解产物也不同。在185~200°C时,NH4NO3分解生成笑气(N2O)和水,分解生成的氧化产物与还原产物的质量比为__________。超过400°C,NH4NO3剧烈分解生成N2、NO2和H2O,并发生爆炸,若32g NH4NO3爆炸放出12.3 kJ的热量,则NH4NO3分解爆炸的热化学方程式为______________。
(3)电解NO制备 NH4NO3,其工作原理如图所示,阴极反应式为___________________;电解反应的总方程式为___________________;为使电解产物全部转化为NH4NO3,需补充物质A,A是__________。
电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与右图中电解池相连,其中,a为电解液,X和Y是两块电极板,则:

(1)若X、Y依次为铜和铁,a仍为CuSO4溶液,且反应过程中未生成Fe3+,则Y极的电极反应式为
(2)若用此装置电解精炼铜, 做阳极,电解液CuSO4的浓度 (填“增大”、“减小”或“不变”)。
(3)PbO2可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生反应的电极反应式为 ;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为 。
(4)如图:A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。

比较A、B、C中铁被腐蚀的速率,由快到慢的顺序为 (填字母序号)。
(18分)(1)某催化剂可将汽车尾气中的CO、NO转化为无毒气体。已知:
②可以利用反应: (n可以为零)将NO2变成无害N2,若要求X必须为无污染的物质,则G可以是_________(填写字母)。
(n可以为零)将NO2变成无害N2,若要求X必须为无污染的物质,则G可以是_________(填写字母)。
a.NH3 b.CO2 c.SO2 d.CH3CH2OH
当反应中转移1.2mol电子时,消耗NO2____________L(标准状况)。
③用NaOH溶液吸收工业尾气中的SO2最终制得石膏(CaSO4.2H2O)。为节约资源减少排放实现物质的循环利用,生产过程中还需要加入的固体物质是____________(填化学式)。
(2)工业上通过电解含NH4F的无水熔融物生产NF3气体,其电解原理如图所示。则a极为___________极,该极的电极反应式________________________________________
(3)用电镀法在铁板表面镀锌或锡可防腐,这种防止金属腐蚀的方法从原理上属于_______法。