Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++FeS+2e—=Li2S+Fe。有关该电池的下列说法中,正确的是
| A.Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价 |
| B.该电池的电池反应式为:2Li+FeS=Li2S+Fe |
C.负极的电极反应式为Al-3 =Al3+ =Al3+ |
| D.充电时,阴极发生的电极反应式为:Li2S+Fe-2e—=2Li++FeS |
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如下图装置①。该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列叙述不正确的是
| A.该燃料电池负极发生的电极反应为:N2H4+4OH--4e-===N2+4H2O |
| B.用该燃料电池作为装置②的直流电源,产生1 mol Cl2至少需要通入0.5 mol N2H4 |
| C.该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 |
| D.该燃料电池中,电子从右侧电极经过外电路流向左侧电极,溶液中OH-则迁移到左侧 |
我国知名企业比亚迪公司开发了具有多项专利的锂钒氧化物二次电池,其成本较低,对环境无污染,能量密度远远高于其他材料电池,电池总反应为V2O5+xLi LixV2O5.下列说法中正确的是
LixV2O5.下列说法中正确的是
| A.电池在放电时,Li+向负极移动 |
| B.锂在放电时做正极,充电时为阳极 |
| C.该电池充电时阳极的反应为LixV2O5﹣xe﹣═V2O5+xLi+ |
| D.V2O5只是锂发生反应的载体,不参与电池反应 |
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
| A.充电时阳极反应:Ni(OH)2-e- + OH- ="NiOOH" + H2O |
| B.充电过程是化学能转化为电能的过程 |
| C.放电时负极附近溶液的碱性不变 |
| D.放电时电解质溶液中的OH -向正极移动 |
将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是
| A.整个过程中阳极先产生Cl2,后产生O2。 |
| B.阳极产物一定是Cl2,阴极产物一定是Cu |
| C.BC段表示在阴极上是H+放电产生了H2 |
| D.CD段表示阳极上OH一放电破坏了水的电离平衡,产生了H+ |
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如图所示, 则下列有关说法中不正确的是
| A.X为直流电源的负极,Y为直流电源的正极 |
| B.阳极区pH增大 |
| C.图中的b>a |
| D.该过程中的产品主要为H2SO4和H2 |
将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,
则下列说法正确的是
| A.阳极产物一定是Cl2,阴极产物一定是Cu |
| B.BC段表示在阴极上是H+放电产生了H2 |
| C.整个过程中阳极先产生Cl2,后产生O2 |
| D.CD段表示阳极上OH一放电破坏了水的电离平衡,产生了H+ |
最近有研究人员发现了一种处理高浓度乙醛废水的新方法—隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸。实验室以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如右图所示。下列说法不正确的是 
| A.若以CH4—空气燃料电池为直流电源,燃料电池的a极应通入空气 |
| B.阳极反应CH3CHO -2e- + H2O = CH3COOH +2H+ |
| C.电解过程中,阴极区Na2SO4的物质的量增大 |
| D.电解过程中,两极除分别生成乙酸和乙醇外,均产生了无色气体,则阳极产生的是O2 |
用下图Ⅰ所示装置通电10分钟后,去掉直流电源,连接成图Ⅱ所示装置,可观察到U形管左端铁电极表面析出白色胶状物质,U形管右端液面上升.下列说法正确的是
| A.同温、同压下,装置Ⅰ中石墨电极上方得到的气体比铁电极上方得到的气体多 |
| B.用装置Ⅱ进行实验时铁电极的电极反应为Fe-2e-+2OH-= Fe(OH)2 |
| C.用装置Ⅱ进行实验时石墨电极的电极反应为2H++2e-="==" H2↑ |
| D.装置Ⅰ通电10分钟后铁电极周围溶液pH降低 |
下列说法正确的是( )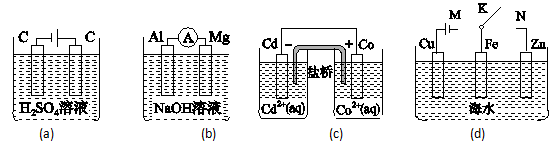
| A.图(a)中,随着电解的进行,溶液中H+的浓度越来越小 |
| B.图(b)中,Mg电极作电池的负极 |
| C.图(c)中,发生的反应为Co+Cd2+=Cd+Co2+ |
| D.图(d)中,K分别与M、N连接时,Fe电极均受到保护 |
将质量相等的铜片和铂片插入硫酸铜溶液中,铜片与电源正极相连铂片与电源负极相连,以电流强度1A通电10min,然后反接电源,以电流强度2A继续通电10min。下列表示铜电极.铂电极.电解池中产生气体的质量和电解时间的关系图正确的是( ) 
用Pt电极电解含有各0.1 mol Cu2+和X3+的溶液,阴极析出固体物质的质量m(g)与溶液中通过电子的物质的量n(mol)的关系见图所示。则离子的氧化能力由大到小排列正确的是
| A.Cu2+>X3+>H+ | B.H+>X3+>Cu2+ |
| C.X3+>H+>Cu2+ | D.Cu2+>H+>X3+ |
镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型,NiMH中的M表示储氢金属或合金,该电池在充电过程中的总反应方程式是Ni(OH)2+M===NiOOH+MH。
已知:6NiOOH+NH3+H2O+OH-===6Ni(OH)2+NO
下列说法正确的是
| A.NiMH电池放电过程中,正极的电极反应式为NiOOH+H2O+e-===Ni(OH)2+OH- |
| B.充电过程中OH-从阳极向阴极迁移 |
| C.充电过程中阴极的电极反应式:H2O+M+e-===MH+OH-,H2O中的H被M还原 |
| D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液 |
下图所示的电解池Ⅰ和Ⅱ中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d。符合上述实验结果的盐溶液是
| 选项 |
X |
Y |
| A. |
MgSO4 |
CuSO4 |
| B. |
AgNO3 |
Pb(NO3)2 |
| C. |
FeSO4 |
Al2 (SO4)3 |
| D. |
CuSO4 |
AgNO3 |