(1)据报道以硼氢化合物NaBH4(H的化合价为-1价) 和 H2O2作原料的燃料电池,可用作通信卫星电源。负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示。写出该电池放电时负极的电极反应式: 。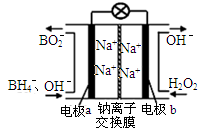
(2)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂。
已知:N2H4(l) + O2(g) = N2(g)+ 2H2O(l) △H =" –" 534 kJ·mol—1
H2O2(l)= H2O(l) + 1/2O2(g) △H =" –" 98.6 kJ·mol—1
写出常温下,N2H4(l) 与H2O2(l)反应生成N2和H2O的热化学方程式: 。
(3)O3可由臭氧发生器(原理如图所示)电解稀硫酸制得。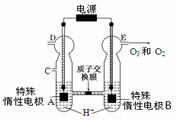
①图中阴极为 (填“A”或“B”)。
②若C处通入O 2,则A极的电极反应式为: 。
(4)向一密闭容器中充入一定量的一氧化碳和水蒸气,发生反应:
CO(g)+H2O(g) CO2(g)+H2(g),下列情况下能判断该反应一定达到平衡状态的是_______(选填编号)。
CO2(g)+H2(g),下列情况下能判断该反应一定达到平衡状态的是_______(选填编号)。
| A.v正(H2O) = v逆(H2) |
| B.容器中气体的压强不再发生改变 |
| C.H2O的体积分数不再改变 |
| D.容器中CO2和H2的物质的量之比不再发生改变 |
E.容器中气体的密度不再发生改变
(5)温度T1时,在一体积为2L的密闭容积中,加入0.4molCO2和0.4mol的H2,反应中c(H2O)的变化情况如图所示,T1时反应CO(g)+H2O(g) CO2(g)+H2(g)第4分钟达到平衡。在第5分钟时向体系中同时再充入0.1molCO和0.1molH2(其他条件不变),请在右图中画出第5分钟到9分钟c(H2O)浓度变化的曲线。
CO2(g)+H2(g)第4分钟达到平衡。在第5分钟时向体系中同时再充入0.1molCO和0.1molH2(其他条件不变),请在右图中画出第5分钟到9分钟c(H2O)浓度变化的曲线。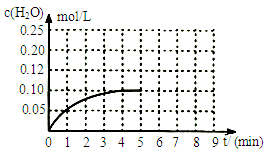
氮化硅(Si3N4)是一种优良的高温结构陶瓷,在航天航空、汽车发动机、机械等领域有着广泛的用途。工业上有多种方法来制备氮化硅,常见的方法有:
(1)在1 300-l 400℃时,高纯粉状硅与纯氮气化合,其反应方程式为_________。
(2)在高温条件下利用四氯化硅气体、纯氮气、氢气反应生成氮化硅和HCl。
①已知:25℃,101 kPa条件下的热化学方程式:
3Si(s)+2N2(g)=Si3N4(s) △H= -750.2kJ/mol
Si(s)+2Cl2(g)=SiCl4(g) △H="-609.6" kJ/mol
H2(g)+Cl2(g)=2HCl(g) △H="--184.6" kJ/mol
四氯化硅气体与氮气、氢气反应的热化学方程式为____________________。
②工业上制取高纯硅和四氯化硅的生产流程如下:
已知:X,高纯硅、原料B的主要成分都可与Z反应,Y与X在光照或点燃条件下可反应,Z的焰色呈黄色。
上述生产流程中电解A的水溶液时,阳极材料能否用Cu?________(填“能”或“不能”)。写出Cu为阳极电解A的水溶液开始一段时间阴阳极的电极方程式。阳极: ;阴极: 。
(3)由石英砂合成氮化硅粉末的路线图如下所示
(把图中的①·⑤改为I-V)
①石英砂不能与碱性物质共同存放,以NaOH为例,用化学方程式表示其原因: 。
②图示I-V的变化中,属于氧化还原反应的是 。
③SiCl4在潮湿的空气中剧烈水解,产生白雾,军事工业中用于制造烟雾剂。SiCl4水解的化学方程式为___________________。
④在反应IV中四氯化硅与氨气反应生成Si(NH2)4和一种气体 (填分子式);在反应V中Si(NH2)4受热分解,分解后的另一种产物的分子式为 。
NH3经一系列反应可以得到HNO3和NH4NO3,如下图所示。
(1)Ⅰ中,NH3和O2在催化剂作用下反应,其化学方程式是 。
(2)Ⅱ中,2NO(g)+O2(g) 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(ρ1、ρ2)下随温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(ρ1、ρ2)下随温度变化的曲线(如图)。
①比较ρ1、ρ2的大小关系: 。
②随温度升高,该反应平衡常数变化的趋势是 。
(3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
(1)已知:2NO(g) N2O4(g) ΔH1
N2O4(g) ΔH1
2NO2(g) N2O4(l) ΔH2
N2O4(l) ΔH2
下列能量变化示意图中,正确的是(选填字母) 。

②N2O4与O2、H2O化合的化学方程式是 。
(4)Ⅳ中,电解NO制备NH4NO3,其工作原理如图所示。为使电解产物全部转化为NH4NO3,需补充物质A。A是 ,说明理由 。
二氧化硫和氮氧化物都是常见的大气污染物,回答下列相关问题。
Ⅰ某温度下氮氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
i.2NO(g)+Cl2(g) 2ClNO(g) △H1< 0 其平衡常数为K1
2ClNO(g) △H1< 0 其平衡常数为K1
ii.2NO2(g)+NaCl(s)  NaNO3(s)+ClNO(g) △H2<0 其平衡常数为K2
NaNO3(s)+ClNO(g) △H2<0 其平衡常数为K2
(1)现有反应4NO2(g)+2NaCl(s)  2NaNO3(s)+2NO(g)+Cl2(g),则此反应的平衡常数K3= (用K1、K2表示),反应热△H3= (用△H1、△H2表示)。
2NaNO3(s)+2NO(g)+Cl2(g),则此反应的平衡常数K3= (用K1、K2表示),反应热△H3= (用△H1、△H2表示)。
(2)为研究不同条件对反应ii的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO2和足够的NaCl(s),10min时反应ii达到平衡。测得平衡时NO2的转化率α1(NO2) =50%,则:
①10min内υ(ClNO) = ,平衡常数K2= ;
②若其它条件不变,使反应在恒压条件下进行,平衡时NO2转化率为α2(NO2),则:
α1(NO2) = α2(NO2)(填“>”“<”或“=”)。
II除氮氧化物外,SO2也是重要的大气污染物,需要对其进行吸收处理。
(3)若用一定量的NaOH溶液吸收SO2气体后所得吸收液恰好呈中性,下列有关吸收液中粒子关系正确的是 。
| A.c(Na+) = c(HSO3-)+ 2c(SO32-) |
| B.c(Na+) > c(HSO3-) =c(SO32-) > c(H+) = c(OH—) |
| C.2c(Na+) =2c(H2SO3)+2c(HSO3-)+2c(SO32-) |
| D.c(Na+) > c(HSO3—) + c(SO32—) +c(H2SO3) |
(4)工业上也可以用Na2SO3溶液吸收SO2,并用电解法处理吸收后所得溶液以实现吸收液的回收再利用,装置如图所示,则
①工作一段时间后,阴极区溶液的pH (填“增大”“减小”或“不变”);
②写出阳极的电极反应式 。
观察下列几个装置示意图,有关叙述正确的是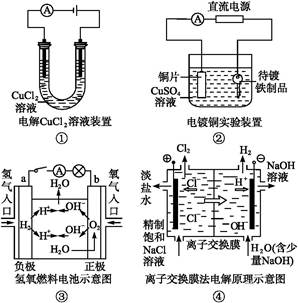
| A.装置①中阳极上析出红色固体 |
| B.装置②的待镀铁制品应与电源正极相连 |
| C.装置③闭合电键后,外电路电子由a极流向b极 |
| D.装置④的离子交换膜允许阳离子、阴离子、水分子自由通过 |
辉铜矿(主要成分为Cu2S)经火法冶炼,可制得Cu和H2SO4,流程如下图所示:
(1)Cu2S中Cu元素的化合价是 价。
(2)Ⅱ中,电解法精炼粗铜(含少量Ag、Fe),CuSO4溶液做电解质溶液:
①粗铜应与直流电源的 极(填“正”或“负”)相连。
②铜在阴极析出,而铁以离子形式留在电解质溶液里的原因是 。
(3)Ⅲ中,烟气(主要含SO2、CO2)在较高温度经下图所示方法脱除SO2,并制得H2SO4。
①在阴极放电的物质是 。
②在阳极生成SO3的电极反应式是 。
(4)检测烟气中SO2脱除率的步骤如下:
i.将一定量的净化气(不含SO3)通入足量NaOH溶液后,再加入足量溴水。
ii.加入浓盐酸,加热溶液至无色无气泡,再加入足量BaCl2溶液。
iii.过滤、洗涤、干燥,称量沉淀质量。
①用离子方程式表示i中溴水的主要作用 。
②若沉淀的质量越大,说明SO2的脱除率越 (填“高”或“低”)。
煤粉中的氮元素在使用过程中的转化关系如下图所示:
(1)②中NH3参与反应的化学方程式为 。
(2)③中加入的物质可以是 (填字母序号)。
a.空气 b.CO c.KNO3 d.NH3
(3)焦炭氮中有一种常见的含氮有机物吡啶( ),其分子中相邻的C和N原子相比,N原子吸引电子能力更 (填“强”或“弱”),从原子结构角度解释原因: 。
),其分子中相邻的C和N原子相比,N原子吸引电子能力更 (填“强”或“弱”),从原子结构角度解释原因: 。
(4)已知:N2(g) + O2(g)  2NO(g) ΔH =" a" kJ·mol-1
2NO(g) ΔH =" a" kJ·mol-1
N2(g) + 3H2(g)  2NH3(g) ΔH =" b" kJ·mol-1
2NH3(g) ΔH =" b" kJ·mol-1
2H2(g) + O2(g)  2H2O(l) ΔH =" c" kJ·mol-1
2H2O(l) ΔH =" c" kJ·mol-1
反应后恢复至常温常压,①中NH3参与反应的热化学方程式为 。
(5)用间接电化学法除去NO的过程,如下图所示:
已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式: 。
用离子方程式表示吸收池中除去NO的原理: 。
人工固氮是指将氮元素由游离态转化为化合态的过程。
I.最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实验氮的固定一电解法合成氨,大大提高了氮气和氢气的转化率。
总反应式为N2+3H2 2NH3。则在电解法合成氨的过程中,应将H2不断地通入_________极(填“阴”或“阳”);
2NH3。则在电解法合成氨的过程中,应将H2不断地通入_________极(填“阴”或“阳”);
向另一电极通入N2,该电极的反应式为__________________________。
II.据报道,在一定条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,主要产物为NH3相应的反应方程式为:2N2(g)+6H2O(g)  4NH3(g)+3O2(g)△H=Q
4NH3(g)+3O2(g)△H=Q
(1)上述反应的平衡常数表达式为_______________。
(2)取五份等体积N2和H2O的混合气体(物质的量之比均为1:3),分别加入体积相同的恒容密闭容器中,在温度不相同的情况下发生反应,反应相同时间后,测得氮气的体积分数 (N2)与反应温度T的关系曲线如下图所示,则上述反应的Q________0(填“>”、“<”或“=”)。
(N2)与反应温度T的关系曲线如下图所示,则上述反应的Q________0(填“>”、“<”或“=”)。
(3)若上述反应在有催化剂的情况下发生,则下图所示的a、b、c、d四条曲线中,能表示反应体系能量变化的是_______(填字母代号),图中△H绝对值为1530kJ·mol-1。
III.目前工业合成氨的原理是:N2(g)+3H2 (g)  2NH3(g)△H=-93.0kJ·mol-1
2NH3(g)△H=-93.0kJ·mol-1
回答下列问题:
结合II中的数据,则2H2 (g)+O2 (g)=2H2O(g)的△H=___________。
(2)在一定温度下,将1molN2和3mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8mol。
①达平衡时,H2的转化率 ______________。
______________。
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率为a2,当a1+a2=1时,则起始时NH3的物质的量n(NH3)= _________mol。
第五主族的磷单质及其化合物在工业上有广泛应用。
(1)同磷灰石在高温下制备黄磷的热化学方程式为:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g),△H
已知相同条件下:
4Ca3(PO4)2F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) , △H1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g) ,△H2
SiO2(s)+CaO(s)=CaSiO3(s) ,△H3
用△H1、△H2和△H3表示△H,则△H=____________________;
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子产物,其结构式为_________,三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为____________;
(3)次磷酸钠(NaH2PO2)可用于工业上的化学镀镍。
①化学镀镍的溶液中含有Ni2+和H2P ,在酸性等条件下发生下述反应:
,在酸性等条件下发生下述反应:
(a)_____ Ni2+ + ____ H2P + _____ → ___Ni++______ H2P
+ _____ → ___Ni++______ H2P + ____
+ ____
(b)6 H2P +2H+ =2P+4H2PO3+3H2↑
+2H+ =2P+4H2PO3+3H2↑
请在答题卡上写出并配平反应式(a);
②利用①中反应可在塑料镀件表面沉积镍—磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀。请从以下方面比较化学镀与电镀。
方法上的不同点:________________________________;
原理上的不同点:__________________________________;
化学镀的优点:____________________________________。
(14 分)碳及其化合物应用广泛。
I.工业上利用CO和水在沸石分子筛表面反应制氢气,CO(g)+H2O(g)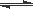 CO2(g)+H2(g)
CO2(g)+H2(g)
(1)向 1L恒容密闭容器中注入CO和H2O(g),830oC时,测得部分数据如下表。
| t/min |
0 |
1 |
2 |
3 |
4 |
5 |
| n(CO)/mol |
0.200 |
0.160 |
0.125 |
0.099 |
0.080 |
0.080 |
| n(H2O)/mol |
0.300 |
0.260 |
0.225 |
0.199 |
0.180 |
0.180 |
则该温度下反应的平衡常数K=
(2)相同条件下,向 1L恒容密闭容器中,同时注入1molCO、1molH2O(g)、2molCO2和2molH2,此时
v(正) v(逆)(填“>”“=”或“<”)
II.已知:CO(g)+1/2O2(g)=CO2(g) △H1=-141kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H2=-484kJ·mol-1
CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(g) △H3=-726kJ·mol-1
(3)利用CO、H2化合制得液态甲醇的热化学方程式为
Ⅲ.一种新型氢氧燃料电池工作原理如下图所示。
(4)写出电极A的电极反应式 ,放电过程中,溶液中的CO32-将移向电极 (填A或B)
(5)以上述电池电解饱和食盐水,若生成0.2mol Cl2,则至少需通入O2的体积为 L(标准状况)
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请完成以下问题:
(1)若X、Y者是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中化学反应方程式为_____________,在X极附近观察到的现象是_________________。
②检验Y电极上反应产物的方法是_________________________。
③当导线中有0.1 mol的电子通过时,在标况下理论上两极可收集的气体的体积是__ __L。
(2)下图装置中,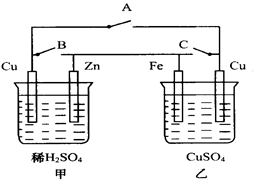
①当A键断开,B、C闭合时,乙为 池;
②当A、C两键断开, B闭合时,乙中铁极增重1.6g,则被氧化的铁有 g;
③将乙中两极都换成石墨,硫酸铜溶液换H2SO4后断开B、C两键, 闭合A键,则乙为 池,当甲中锌极减轻6.5g时,乙中共放出气体 mL(标况)。
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
(1)处理NOx的一种方法是利用甲烷催化还原NOx.已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为 .
(2)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g) N2(g)+2CO2(g);△H<0.若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示,该反应的化学平衡常数为K= .
N2(g)+2CO2(g);△H<0.若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示,该反应的化学平衡常数为K= .
若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将 移动(填“向左”、“向右”或“不”).
20min时,若改变反应条件,导致N2浓度发生如图所示的变化,则改变的条件可能是 (填序号).
①加入催化剂 ②降低温度
③缩小容器体积 ④增加CO2的量
(3)肼(N2H4)用亚硝酸氧化可生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977.写出肼与亚硝酸反应的化学方程式 .
(4)如图所示装置可用于制备N2O5,则生成N2O5的那一极电极反应式为 .
(15分)某铜矿石的成分中含有Cu2O,还含有少量的Al2O3、Fe203和Si02。某工厂利用此矿石炼制精铜的工艺流程示意图如下: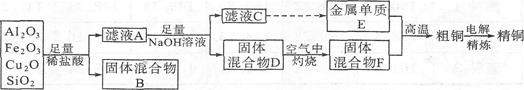
已知:CuO2+2H+=Cu+Cu2++H2O
(1)滤液A中铁元素的存在形式为 (填离子符号),生成该离子的离子方程式为 ,检验滤液A中存在该离子的试剂为 (填试剂名称)。
(2)金属E与固体F发生的某一反应可用于焊接钢轨,该反应的化学方程式为 。
(3)常温下.等pH的NaAlO2和NaOH两份溶液中,由水电离出的c(OH一)前者为后者的108倍,则两种溶液的pH= 。
(4)将Na2CO3溶液滴入到一定量的CuCl2溶液中,除得到蓝色沉淀,还有无色无味气体放出,写出相应的离子方程式: 。
(5)①粗铜的电解精炼如图所示。在粗铜的电解精炼过程中,c为粗铜板,则a端应连接电源的 (填“正”或“负”)极,若粗铜中含有Au、Ag、Fe杂质,则电解过程中c电极上发生反应的方程式有 、 。
②可用酸性高锰酸钾溶液滴定法测定反应后电解液中铁元素的含量。滴定时不能用碱式滴定管盛放酸性高锰酸钾溶液的原因是 、滴定中发生反应的离子方程式为 , 滴定时.锥形瓶中的溶液接触空气,则测得铁元素的含量会 (填“偏高”或“偏低”)。
K2CO3有广泛的用途。
(1)钾肥草木灰中含有K2CO3、K2SO4、KCl等。将草木灰用水浸取,过滤、蒸发得浓缩液。
①该浓缩液呈碱性的原因用离子方程式表示为 。
②检验该浓缩液中Cl-所用的试剂有 。
| A.AgNO3溶液 |
| B.硝酸 |
| C.盐酸 |
| D.Ba(NO3)2溶液 |
E.BaCl2溶液
(2)工业上曾利用如下反应生产碳酸钾:K2SO4 + C + CaCO3 → K2CO3+ X+ CO2↑(未配平)
已知X为两种元素组成的化合物,则X的化学式为 ;反应中氧化剂与还原剂物质的量之比为 。
(3)离子膜电解-炭化法是目前生产碳酸钾的常用的方法。
第一步:精制KCl溶液
粗KCl中含有Ca2+、Mg2+等离子,按以下流程精制: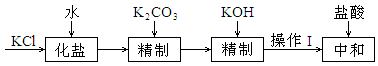
已知:加入K2CO3后,溶液中部分Mg2+转化为MgCO3沉淀。
Ksp[Mg(OH)2]=5.6×10-12,Ksp(CaCO3)=2.8×10-9,Ksp(MgCO3)=6.8×10-6。
①操作Ⅰ的名称是 。
②当加入KOH后,溶液中n(CO32-)增大,主要原因是 。
第二步:电解精制后的KCl溶液制取KOH,其它产物制取盐酸。
第三步:将KOH与CO2反应转化为KHCO3,再将KHCO3分解得到产品。
③离子膜电解-炭化法的整个过程中,可以循环利用的物质有 。
(15分)工业生产中产生的SO2、NO直接排放将对大气造成严重污染。利用电化学原理吸收SO2和NO,同时获得 Na2S2O4和 NH4NO3产品的工艺流程图如下(Ce为铈元素)。
请回答下列问题:
(1)装置I中生成HSO-3的离子方程式为 。
(2)含硫各微粒(H2SO3、HSO-3和SO2-3)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如下图所示。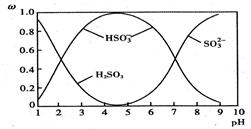
①下列说法正确的是 (填标号)。
| A.pH = 7时,溶液中c( Na+) < c (HSO-3) + c(SO2-3) |
| B.由图中数据,可以估算出H2SO3的第二级电离平衡常数K2≈10-7 |
| C.为获得尽可能纯的 NaHSO3,应将溶液的pH控制在 4~5为宜 |
| D.pH = 9时溶液中 c(OH-)=" c" (H+) + c(HSO-3)+ 2c(H2SO3) |
②向pH = 5的NaHSO3溶液中滴加一定浓度的 CaCl2溶液,溶液中出现浑浊,其pH 降为2 ,用化学平衡移动原理解释溶液 pH 降低的原因 。
(3)装置Ⅱ中的反应在酸性条件下进行,写出NO被氧化为NO-2离子方程式 。
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。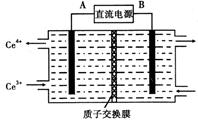
图中A为电源的 (填“正”或“负”)极。右侧反应室中发生的主要电极反应式为 。
(5)已知进人装置Ⅳ的溶液中NO-2的浓度为 0.75 mol/L ,要使 1m3该溶液中的NO-2完全转化为 NH4NO3,需至少向装置Ⅳ中通入标准状况下的 O2的体积为 L 。