在如图所示的装置中,若通直流电5min时,铜电极质量增加2.16 g。试回答下列问题。
(1)电源中X电极为直流电源的________极。
(2)pH变化:A:________,B:________,C:________。(填“增大”、“减小”或“不变”)
(3)通电5 min时,B中共收集224 mL (标准状况下) 气体,溶液体积为200 mL,则通电前CuSO4溶液的物质的量浓度为________(假设电解前后溶液体积无变化)。
(4)若A中KCl足量且溶液的体积也是200 mL,电解后,溶液的pH为________(假设电解前后溶液体积无变化)。
某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生且溶液不变蓝,下列叙述正确的是
| A.铜电极上发生还原反应 |
| B.石墨电极附近溶液呈红色 |
| C.溶液中的Na+向石墨电极移动 |
| D.铜电极附近观察到黄绿色气体 |
下列说法正确的是( )
A.根据反应Cu+H2SO4 CuSO4+H2↑可推出Cu的还原性比H2的强 CuSO4+H2↑可推出Cu的还原性比H2的强 |
| B.电解含Pb(NO3)2和Cu(NO3)2的溶液,阴极上阳离子得电子次顺依次是 Cu2+、H+、Pb2+ |
| C.含amolNa2S的溶液最多能吸收2.5amol的二氧化硫气体 |
| D.因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3===2NaIO3+Cl2不能发生 |
(原创)下列表达式正确的是
| A.CH3COOH溶液中CH3COOH的电离:CH3COOH =" H" + + CH3COO— |
B.用CuCl2溶液做导电实验,灯泡发光:CuCl2 Cu2++2Cl- Cu2++2Cl- |
C.NaHCO3溶液中HCO3一的水解:HCO3一+ H2O  H3O + + CO32一 H3O + + CO32一 |
| D.将FeCl3溶液滴入Na2CO3溶液中:2Fe3+ + 3 CO32‾+ 3 H2O = 2Fe(OH)3 ↓+ 3 CO2↑ |
常温下,用惰性电极电解1L含足量KCl的溶液,若电路中通过amol电子的电量,则溶液的pH与n的关系是(设电解前后溶液的体积不变,生成的气体全部逸出)( )
| A.pH=n | B.pH=-lgn | C.pH=14-lgn | D.pH=lgn+14 |
无水氯化铝是一种重要的催化剂,工业上由Al2O3制备无水氯化铝的反应为:2Al2O3(s)+6Cl2(g) 4AlCl3(g)+3O2(g)△H>0.下列分析错误的是
4AlCl3(g)+3O2(g)△H>0.下列分析错误的是
| A.增大反应体系的压强,反应速率可能加快 |
| B.加入碳粉,平衡向右移动,原因是碳与O2反应,降低了生成物的浓度且放出热量 |
| C.电解熔融的Al2O3和AlCl3溶液均能得到单质铝 |
| D.将AlCl3•6H2O在氯化氢气流中加热,也可制得无水氯化铝 |
下列关于铜电极的叙述中正确的是
| A.铜锌原电池中铜是负极 |
| B.用电解法精炼粗铜时粗铜作阳极 |
| C.在铁上电镀铜时用铜作阴极 |
| D.电解稀硫酸时用铜作阳极,阳极产生氧气 |
下列四个装置图均与电化学有关,请根据图示回答相关问题:
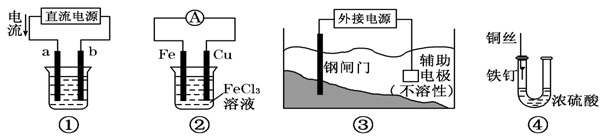
(1)这四个装置中,利用电解原理的是 (填装置序号);
(2)装置①若用来精炼铜,则a极的电极材料是 (填“粗铜”或“精铜”),电解质溶液为 ;
(3)装置②的总反应方程式是 ;
(4)装置③中钢闸门应与外接电源的 极相连(填“正”或“负”)
(5)装置④中的铁钉几乎没被腐蚀,其原因是 。
下列各组中,每种电解质溶液电解时只生成氢气和氧气的是
| A.NaOH、H2SO4、Ba(OH)2 | B.NaOH、CuSO4、H2SO4 |
| C.HCl、CuCl2、Ba(OH)2 | D.NaBr、H2SO4、Ba(OH)2 |
将0.1 mol AgNO3和0.2mol Cu(NO3)2固体溶于水配成100 mL溶液,用惰性电极电解一段时间后,在一极上析出0.15 mol O2,此时,另一极上析出的气体体积(标准状况)为( )
| A.1.12L | B.2.24 L | C.3.36 L | D.4.48L |
下列各组溶液电解一段时间后,再加入相关物质,溶液能恢复原来组成的是
| |
电解质溶液 |
阳极 |
阴极 |
加入的物质 |
| A |
NaCl溶液 |
碳 |
铁 |
盐酸 |
| B |
稀硫酸 |
铜 |
碳 |
水 |
| C |
硫酸铜溶液 |
铜 |
碳 |
硫酸铜 |
| D |
NaOH溶液 |
碳 |
铁 |
水 |
在25 ℃时,用石墨电极电解2.0 L 0.5mol·L-1 CuSO4溶液。5min后,在一个石墨电极上有6.4 g Cu生成。试回答下列问题。
(1)发生氧化反应的是__________极,电极反应式为____________。
(2)若电解后溶液的体积不变,则电解后溶液的pH为____________。
(3)若将溶液恢复到与电解前一样,则需加入________mol的_______。
下列说法正确的是( )
| A.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,则△H<0 |
| B.铁片镀锌时,铁片与外电源的正极相连 |
| C.以熔融NaCl为电解质进行电解冶炼钠,熔融体中Na+向阳极移动 |
D.t℃时,恒容密闭容器中反应:NO2(g)+SO2(g) NO(g)+SO3(g),通入少量O2, NO(g)+SO3(g),通入少量O2,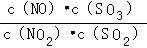 的值及SO2转化率不变 的值及SO2转化率不变 |
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 |
Na+、K+、Cu2+ |
| 阴离子 |
SO42-、OH- |
在下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。
接通电源,经过一段时间后,测得乙烧杯中c电极质量增加了16 g。常温下各烧杯中溶液的pH与电解时间t的关系如图。据此回答下列问题:
(1)M为电源的_____极(填“正”或“负”),电极b上发生的电极反应为__________________________。
(2)电极e上生成的气体在标准状态下的体积为________。
(3)写出乙烧杯中的电解池反应_______________________。
(4)若电解过程中,乙烧杯中的B溶液中的金属离子全部析出,此时电解还能继续进行,原因是___________________________________。
(5)若经过一段时间后,测得乙烧杯中c电极质量增加了16 g,要使丙烧杯中的C溶液恢复到原来的状态,正确的操作是_____________________________________。