(I)一种新型的熔融盐燃料电池具有高发电效率而备受重视。现用Li2CO3和Na2CO3的熔融盐混合物做电解质,一极通入CO气体,另一极通入空气与CO2的混合气体,制得燃料电池。该电池工作时的正极反应式为: ;
(II)某课外活动小组用如图装置进行实验,试回答下列问题:
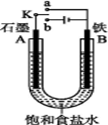
(1)若开始时开关K与a连接,则B极的电极反应为 。 向B极附近滴加铁氰化钾溶液现象是 发生反应的离子方程式
(2)若开始时开关K与b连接,则B极的电极反应为 ,总反应的离子方程式为 。习惯上把该工业生产称为
(3)有关上述实验,下列说法正确的是 。
| A.溶液中Na+向A极移动 |
| B.从A极处逸出的气体能使湿润的KI淀粉试纸变蓝 |
| C.反应很短一段时间后加适量盐酸可恢复到电解前电解质的浓度 |
| D.若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子 |
(4)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。

①该电解槽的阳极反应为 。 此时通过阴离子交换膜的离子数 (填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填“A”、“B”、“C”或 “D”)____________导出。
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因___________________
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。回答下列问题: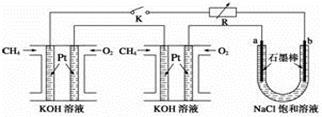
①甲烷燃料电池负极的电极反应为________________________。
②闭合K开关后,a、b电极上均有气体产生,其中b电极上得到的是____________(填化学式),电解氯化钠溶液的总反应方程式为_________________________;
③若每个电池甲烷通入量为1 L(标准状况),且反应完全,则理论上通过电解池的电量为__________(法拉第常数F=9.65×104 C · mol-1,列式计算),最多能产生的氯气体积为__________L(标准状况)。
实验题
I.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的离子方程式有 ;
(2)实验室中现有Na2SO4、MgSO4、FeSO4、K2SO4等4种溶液,可与实验中CuSO4溶液起相似作用的是 ;
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 |
A |
B |
C |
D |
E |
F |
| 4mol/LH2SO4/mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
| 饱和CuSO4溶液/mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
| H2O/mL |
V7 |
V8 |
V9 |
V10 |
10 |
0 |
①完成此实验设计,其中:V1= ,V6= ,V9=
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因 。
Ⅱ、某兴趣组进行下列实验测定某稀硫酸的质量分数,选用酚酞做指示剂。
操作①:取5.00 mL稀H2SO4溶液(密度为1.00 g/mL)置于锥形瓶中加水稀释;
操作②:用0.1000 mol/LKOH标准溶液滴定;
操作③:用同样方法滴定,4次消耗KOH溶液的体积分别为20.00 mL、19.98 mL、20.02 mL、20.40 mL。
请回答下列问题:
(4)如何判定滴定终点:______________________________________________。
(5)在上述实验中,下列操作会造成测定结果偏高的有________(填序号)。
A.锥形瓶用待测液润洗
B.量取稀H2SO4溶液的滴定管用蒸馏水洗净,未用稀H2SO4溶液润洗
C.滴定速度过快,又未摇匀,停止滴定后发现红色褪去
D.滴定前读数时平视,滴定终点读数时仰视
(6)分析数据,计算稀H2SO4溶液中溶质的质量分数为_________ (保留三位有效数字)。
某化学兴趣小组用下图所示装置进行电化学原理的实验探究,试回答下列问题:
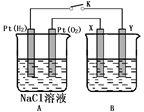
(1)通O2的Pt电极为电池 极(填电极名称);其电极方程式为 。
(2)若B电池为电镀池,目的是在某镀件上镀一层银,则X电极材料为 ;电解质溶液为 。
(3)若B电池为精炼铜,且粗铜中含有Zn、Fe、Ag、Au等杂质,则该电池阳极泥的主要成分是 。
(4)若B电池的电解质溶液为500 mL 1.0 mol/L的NaCl溶液,X、Y皆为惰性电极,当电池工作一段时间 断开电源K,Y电极有560mL(标准状况)无色气体生成(假设电极产生气体完全溢出,溶液体积不变),此时B电池溶液的pH= ;要使该溶液恢复到原来的状态,需加入(填物质并注明物质的量) 。
(5)若X、Y均是铜,电解质溶液为NaOH溶液,电池工作一段时间,X极附近生成砖红色沉淀,查阅资料得知是Cu2O,试写出该电极发生的电极反应式为 。
(10分)为了探究原电池的电极名称不仅与电极材料有关还与电解质溶液有关,某学生做了如下的实验
| 编号 |
电极材料 |
电解质溶液 |
电子流向 |
| ① |
Mg—Al |
HNO3(浓) |
Mg→Al |
| ② |
Mg—Al |
HCl(aq) |
Mg→Al |
| ③ |
Mg—Al |
NaOH(aq) |
Al→Mg |
| ④ |
Al—Cu |
HNO3(浓) |
Cu→Al |
根据以上表格内容回答:
(1)(4分)实验1中Mg作___________(填正极或负极),发生__________(氧化反应或还原反应)
实验3中Mg作________,总反应:__________(同上)
(2)(6分)实验2中Mg电极反应式为__________________。
Al电极上的电极反应式为______________________,总的电池反应是_______________________。
某课外小组探究钠、铝、铁、铜单质还原性强弱及其相关化学性质,做了如下实验:
| 实验1 |
常温时取四种金属少量分别放入装有蒸馏水的试管中 |
| 实验2 |
再取少量铝、铁、铜分别放入装有稀硫酸的试管中 |
(1)实验1中能发生反应的离子方程式 。
(2)实验2中能够判断出铝、铁、铜还原性强弱的现象是 。
结论:由实验1、2得出四种金属的还原性强弱顺序为 ;请从原子结构角度解释钠的还原性强于铝 。
(3)为确认实验2反应后溶液中的金属阳离子,再进行实验:
①取Al反应后的溶液加入过量的NaOH溶液,写出反应的离子方程式 。
②一段时间后,取Fe反应后的溶液,检验Fe2+方法正确的是 。
a.滴加KSCN溶液,无明显变化,再加入少量氯水,溶液变红
b.滴加K3[Fe(CN)6]溶液,有蓝色沉淀产生
c.滴加NaOH溶液,产生的白色沉淀迅速变成灰绿色,最终变成红褐色
(4)在实验2中,铝、铁反应现象的差异并不是很明显,有同学建议再设计一种实验来证明这两种金属的还原性关系,请设计一种实验方案 。
(5)在实验过程中,还有同学为了验证铁与铜的还原性,用铁、铜、导线、烧杯、氯化铁溶液设计了原电池装置。
①画出原电池的装置图 。
②该电池的正极反应为 。
(14 分) 一氧化碳被广泛应用于冶金工业和电子工业。
⑴高炉炼铁是最为普遍的炼铁方法,相关反应的热化学方程式如下:
4CO(g)+Fe3O4(s)=4CO2(g)+3Fe(s) △H="a" kJ·mol-1
CO(g)+3Fe2O3(s)=CO2(g)+2Fe3O4(s) △H="b" kJ·mol-1
反应3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)的△H= kJ·mol-1(用含a、b 的代数式表示)。
⑵电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH3OH(g) HCOOCH3(g)+2H2(g) △H>0
HCOOCH3(g)+2H2(g) △H>0
第二步:HCOOCH3(g) CH3OH(g) +CO(g) △H>0
CH3OH(g) +CO(g) △H>0
①第一步反应的机理可以用下图表示:
图中中间产物X的结构简式为 。
②在工业生产中,为提高CO的产率,可采取的合理措施有 。
⑶为进行相关研究,用CO还原高铝铁矿石,反应后固体物质的X—射线衍射谱图如图所示(X—射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。反应后混合物中的一种产物能与盐酸反应生产两种盐,该反应的离子方程式为 。
⑷某催化剂样品(含Ni2O340%,其余为SiO2)通过还原、提纯两步获得镍单质:首先用CO将33.2 g样品在加热条件下还原为粗镍;然后在常温下使粗镍中的Ni与CO结合成Ni(CO)4(沸点43 ℃),并在180 ℃时使Ni(CO)4重新分解产生镍单质。
上述两步中消耗CO的物质的量之比为 。
⑸为安全起见,工业生产中需对空气中的CO进行监测。
①粉红色的PdCl2溶液可以检验空气中少量的CO。若空气中含CO,则溶液中会产生黑色的Pd沉淀。每生成5.3gPd沉淀,反应转移电子数为 。
②使用电化学一氧化碳气体传感器定量检测空气中CO含量,其结构如图所示。这种传感器利用原电池原理,则该电池的负极反应式为 。
为了减少煤燃烧对大气造成的污染,煤的气化和液化是高效、清洁利用煤炭的重要途径,而减少CO2气体的排放也是人类面临的重大课题。煤综合利用的一种途径如下所示: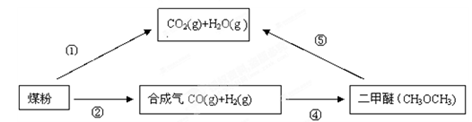
(1)用如图[(1)小题图]所示装置定量检测过程①产生的CO2(已知:煤粉燃烧过程中会产生SO2)B中预期的实验现象是 ,D中的试剂是 。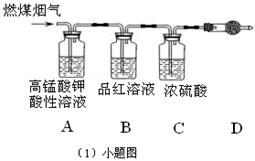
(2)已知① C(s) + H2O(g) = CO(g) + H2 (g) ; ΔH1 =" +131.3" kJ·mol-1
② C(s) + 2H2O(g) = CO2(g) + 2H2(g) ;ΔH2 =" +90" kJ·mol-1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是 。
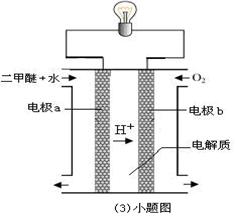
(3)用(3)小题图装置可以完成⑤的转化,同时提高能量的利用率。其实现的能量转化形式主要是由 能转化为 能,a的电极反应式是 。
(4)燃煤烟气中的CO2可用稀氨水吸收,不仅可以减少CO2的排放,也可以生产化肥碳酸氢铵。假设该方 法每小时处理含CO2的体积分数为11.2%的燃煤烟气 1000 m3(标准状况),其中CO2的脱除效率为80%,则理论上每小时生产碳酸氢铵 kg。
某同学在探究废干电池内的黑色固体回收利用时,进行如图所示实验:
查阅教材可知,普通锌锰电池的黑色物质主要成分为MnO2、NH4Cl、ZnCl2等物质。请回答以下问题:
(1) 操作①的名称是 ;
(2)操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、 、泥三角和三脚架;操作③灼烧滤渣中的黑色固体时,产生一种无色无味能使澄清石灰水变浑浊的气体,由此推测灼烧前的滤渣中存在的物质有 。
(3)往操作④的试管中加入操作③灼烧后所得黑色固体,试管中迅速产生能使带火星的木条复燃的气体,据此可初步认定灼烧后的黑色固体为 , 操作④相关的化学方程式为 。
(4)该同学要对滤液的成分进行检验,以确认是否含有NH4+,该同学取少许滤液于试管中, 。 (填写操作与现象),则证实滤液中含有NH4+。
(5)该同学利用在废旧干电池中回收的Zn片和石墨电极,设计一个原电池实验,比较铜与锌的金属活动性强弱。
限用材料:铜片、锌片、石墨电极、稀硫酸、CuSO4溶液、ZnSO4溶液;
限用仪器:直流电源、电流计、导线、烧杯、试管、盐桥等中学化学常见的药品和仪器
请画出实验装置图,并作相应标注,同时写出正极方程式
某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL) |
50 |
120 |
232 |
290 |
310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大___________,原因是___________________________________________________。
(2)哪一时间段的反应速率最小___________,原因是_____________________。
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变) ___________。
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:A.蒸馏水、B.NaCl溶液、C.NaNO3溶液、D.CuSO4溶液、E.Na2CO3溶液,你认为可行的是___________。
(5)把锌与盐酸的反应设计成原电池,请画出装置示意图,标明正负极,电子流动方向,写出正极的电极反应式________________________。
高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂。电解法制备高铁酸钾操作简便,成功率高,易于实验室制备。其原理如下图所示。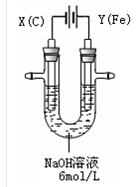
I. 实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
(1)电解过程中,X极是 极,电极反应是 。
(2)电解过程中,Y极放电的有 。
(3)生成高铁酸根(FeO42-)的电极反应是 。
II. 若用不同种电池作为上述实验的电源,请分析电池反应。
(1)铅蓄电池总的化学方程式为:
2H2O+2PbSO4 Pb+PbO2+2H2SO4,则它在充电时的阳极反应为
Pb+PbO2+2H2SO4,则它在充电时的阳极反应为
。
(2)镍镉碱性充电电池在放电时,其两极的电极反应如下:
正极:2NiOOH+2H2O+2e-=2Ni(OH)2+2OH-
负极:Cd+2OH--2e-=Cd(OH)2
则它在放电时的总反应的化学方程式为 。
(3)肼(N2H4)是一种可燃性液体,可用作火箭燃料。已知在25℃、101kPa时,32.0g N2H4在氧气中完全燃烧生成氮气和液态水,放出624kJ的热量,则N2H4完全燃烧的热化学方程式是 ;
肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液,放电时负极的电极反应是 。
(4)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐,电池总反应方程式为:C3H8+5O2=3CO2+4H2O。
写出该电池正极的电极反应: 。
(5)当制备相同物质的量的高铁酸钾时,理论上,上述四种电池中分别消耗的Pb、Cd、肼、丙烷的物质的量之比是 。
某课外活动小组同学用右图装置进行实验,试回答下列问题。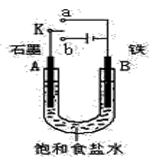
(1)若开始时开关K与a连接,则A极的电极反应式
为 。
(2)若开始时开关K与b连接,则总反应的离子方程式为 。
有关上述实验,下列说法正确的是(填序号) 。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后(设NaCl足量)加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则有0.2 mol电子转移
(3)该小组同学模拟工业上用离子交换膜法制烧碱的方法,那么可以设想用如右图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽的阳极反应式为 。此时通过阴离子交换膜的离子数
(填“大于”或“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填写“A”、 “D”) 导出。
③若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池负极的电极反应式为 。