“雾霾”已成为当今世界环境热点话题,为减少CO、SO2、NOx等气体的排放,某环境小组研究使用如下方式。
Ⅰ.使用清洁能,例如二甲醚( DME)。现由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2(g) CH3OH(g) ΔH1=—90.7KJ/mol
CH3OH(g) ΔH1=—90.7KJ/mol
②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH2=—23.5KJ/mol
CH3OCH3(g)+H2O(g) ΔH2=—23.5KJ/mol
③CO(g)+ H2O(g) CO2(g)+H2(g) ΔH3=—41.2KJ/mol
CO2(g)+H2(g) ΔH3=—41.2KJ/mol
回答下列问题:
(1)则反应3CO(g)+3H2(g)  CH3OCH3(g)+ CO2(g) 的ΔH =______KJ/mol;
CH3OCH3(g)+ CO2(g) 的ΔH =______KJ/mol;
(2)将合成气以甲n(H2)/n(CO)=2通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g) CH3OCH3 (g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示,下列说法正确的是 (填字母序号)。
CH3OCH3 (g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示,下列说法正确的是 (填字母序号)。
A.△H<O
B.P1< P2<p3
C.若在p3和316℃时,起始n(H2)/n( CO)= 3,则达到平衡时,CO的转化率小于50%
(3)如图为绿色“二甲醚燃料电池”的工作原理示意图
a电极的电极反应式为:
Ⅱ.利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s) 5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通人4 mol CO,测得CO2的体积分数
5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通人4 mol CO,测得CO2的体积分数 (CO2)随时间t变化曲线如图。
(CO2)随时间t变化曲线如图。
请回答:(1)从反应开始至a点时的反应速率为v(CO) 。
(2)b点时化学平衡常数Kb= 。
(3)下列说法不正确的是 (填字母序号)。
A.容器内气体密度不变,表明反应达到平衡状态
B.两种温度下,c点时体系中混合气体的压强相等
C.增大d点的体系压强,CO的转化率不变
D.b点和d点的化学平衡常数:Kb<Kd
图一是煤化工产业链的一部分,试运用所学知识,回答下列问题:
图一
(1)图一中气体A的俗称是_______________
(2)合成氨工业是煤化工产业链中非常重要的一步。已知有一组数据:破坏1mol氮气中的化学键需要吸收946 kJ能量;破坏0.5mol氢气中的H-H键需要吸收218kJ的能量;形成氨分子中1 mol N-H键能够释放389kJ能量。图二表示合成氨工业过程中能量的变化,请将图中①、②的能量变化的数值,填在下边的横线上。 
图二
① kJ ,② kJ
(3)煤化工产业的重要产品之一甲醇,是一种新型的汽车动力燃料,发达国家等一般通过CO和H2化合制备甲醇,该反应的化学方程式为:CO (g) + 2H2(g) CH3OH(g)
CH3OH(g)
①下列描述中能说明上述反应已达平衡的是_______;
A. 容器内气体的平均摩尔质量保持不变
B. 2v(H2)正 = v(CH3OH)逆
C. 容器中气体的压强保持不变
D. 单位时间内生成n molCO的同时生成2n mol H2
②在容积固定的恒温密闭容器中充入CO和H2发生上述反应,反应在第4 min时候达到其限度,此时容器中压强与反应前之比为3︰5,容器内物质的各种物质的量浓度如下表:
| 时间/浓度 |
c(CO)(mol/L) |
C(H2 )(mol/L) |
c(CH3OH)(mol/L) |
| 起始 |
0.200 |
0.300 |
0.000 |
| 第4 min |
a |
b |
c |
则b=__________________
(4)甲醇—空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,其工作原理如下图所示,该燃料电池的电池反应式为2CH3OH (g) + 3O2(g) = 2CO2(g) + 4H2O(l),则负极的电极反应式为______________________,正极附近pH值_______________(填写“增大”、“减小”或者“不变”)
(12分)(1)将锌片和银片用导线相连浸入稀硫酸中组成原电池。该电池中负极发生________反应(填“氧化”或“还原”);溶液中的H+移向________(填“正极”或“负极”)材料。
(2)电能是现代社会应用最广泛的能源之一。下图所示的原电池装置中,其负极是__________,正极上能够观察到的现象是____________________________,正极的电极反应式是______________。原电池工作一段时间后,若消耗锌6.5g,则放出气体_______g。
(3)利用下列反应:Fe+2Fe3+=3Fe2+,设计一个化学电池(给出若干导线和一个小灯泡,电极材料和电解液自选):①画出实验装置图;②注明正负极材料和电解质溶液;③标出电子流动方向。
铝是最常见的金属之一。
(1)浓硝酸、浓硫酸可贮存在铝制容器的原因是 。
(2)纳米铝主要应用于火箭推进剂。工业上利用无水氯化铝与氢化铝锂(LiAlH4)在有机溶剂中反应制得纳米铝,化学方程式如下:3LiAlH4+AlCl3="4Al" + 3LiCl + 6H2↑
该反应的氧化剂为 。
(3)氢化铝钠(NaAlH4)是一种重要的储氢材料,已知:
NaAlH4(s)=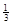 Na3AlH6 (s)+
Na3AlH6 (s)+ 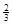 Al (s) + H2(g) ΔH=+ 37 kJ·molˉ1
Al (s) + H2(g) ΔH=+ 37 kJ·molˉ1
Na3AlH6(s)="3NaH(s)+" Al (s) + 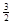 H2(g) ΔH=+ 70.5 kJ·molˉ1
H2(g) ΔH=+ 70.5 kJ·molˉ1
则NaAlH4(s)=" NaH(s)" + Al (s) +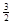 H2(g) ΔH= 。
H2(g) ΔH= 。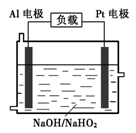
(4)已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式 存在。目前研究比较热门的Al-H2O2燃料电池,其原理如右图所示,电池总反应如下:
2Al+3HO2-+3H2O =2[Al(OH) 4]-+OH-
①正极反应式为 。
②与普通锌锰干电池相比,当消耗相同质量的负极活性物质时,Al-H2O2燃料电池的理论放电量约为普通锌锰干电池的______倍。
③Al电极易被NaOH溶液化学腐蚀,这是该电池目前未能推广使用的原因之一。反应的离子方程式为 。
I.碘钨灯具有使用寿命长、节能环保等优点。一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应: W(g)+ I2(g) WI2(g)
WI2(g)
为模拟上述反应,在实验室中准确称取0.508 g 碘、0.736 g金属钨放置于50.0mL密闭容器中,并加热使其反应。下图一是混合气体中的WI2蒸气的物质的量随时间变化关系的图像[n(WI2) ~ t]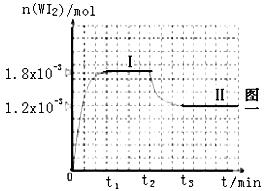
其中曲线Ⅰ(0~t2时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
请回答下列问题:
(1)该反应是 (填写“放热”“吸热”)反应。
(2)反应从开始到t1(t1=" 3" min)时间内的平均速率υ(I2)= mol/(L.min)。
(3)在450℃时,计算该反应的平衡常数K= 。
(4)能够说明上述反应已经达到平衡状态的有 。
| A.I2与WI2的浓度相等 |
| B.单位时间内,金属钨消耗的物质的量与单质碘生成的物质的量相等 |
| C.容器内混合气体的密度不再增加 |
| D.容器内气体压强不变化 |
Ⅱ.图中甲为甲醇燃料电池(电解质溶液为KOH溶液),该同学想在乙中实现铁上镀铜,则a处电极上发生的电极反应式是 。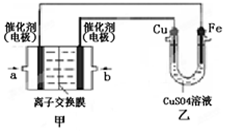
Ⅲ.已知:H2(g)、CO(g)和CH3CH2OH(l)的燃烧热分别为285.8 kJ·mol-1、283.0 kJ·mol-1和1365.5 kJ·mol-1。反应 2CO(g)+4H2(g) CH3CH2OH(l)+H2O(l) 的△H= 。
CH3CH2OH(l)+H2O(l) 的△H= 。
直接排放含SO2,的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2在钠碱循环法中,用Na2SO3溶液作为吸收液,吸收液吸收SO2的过程中,pH随n(SO32-): n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) |
91:9 |
1:1 |
1:91 |
| pH |
8.2 |
7.2 |
6.2 |
(1)上表判断NaHSO3溶液显___________性,用化学平衡原理解释____________________________________________________________________________
(2)当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):
a. c(Na+ )=" 2c(" SO32-) + c( HSO3-)
b. c(Na+ )> c( HSO3-)>c( SO32-) >c(H+)>c(OH-)
c. c(Na+ )+ c(H+)="c(" HSO3-)+c( SO32-) +c(OH-)
当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
(3)HSO3-在阳极放电的电极反应式是_________________________________________
(4)当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:
________________________________________________________________________
工业合成氨与制备硝酸一般可连续生产,流程如图所示:

(1)工业生产时,制取氢气的一个反应为:CO+H2O(g) CO2+H2 T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。
CO2+H2 T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。
(2)合成塔中发生反应N2(g)+3H2(g) 2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1____300℃(填“>”、“<”或“=”)。
2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1____300℃(填“>”、“<”或“=”)。

(3)N2和H2以铁作催化剂从145℃就开始反应,不同温度下NH3的产率如右图所示。温度高于900℃时,NH3产率下降的原因是 。

(4)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g); △H=-574kJ·mol-1;
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g); △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为: 。
(5)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极碱性条件下发生反应的电极反应式为 。
磺酰氯(SO2Cl2)是一种有机氯化剂,也是锂电池正极活性物质。已知磺酰氯是一种无色液体,熔点-54.1℃,沸点69.1℃,遇水发生剧烈水解。
(1)已知:①SO2 (g) +Cl2 (g)+ SCl2 (g) 2SOCl2 (g) △H="a" kJ·mol-1
2SOCl2 (g) △H="a" kJ·mol-1
②SO2Cl2(g)+ SCl2 (g)  2SOCl2(g) △H="b" kJ·mol-1
2SOCl2(g) △H="b" kJ·mol-1
则反应:SO2(g) + Cl2(g) SO2Cl2(g) △H = kJ·mol-1(用含a、b的代数式表示);该反应平衡常数表达式为K = 。
SO2Cl2(g) △H = kJ·mol-1(用含a、b的代数式表示);该反应平衡常数表达式为K = 。
(2)磺酰氯可与白磷发生反应为:P4+ 10SO2Cl2= 4PCl5 + 10SO2↑,若生成1molSO2,则转移电子的物质的量为 mol。
(3)某学习小组的同学依据反应:SO2(g)+ Cl2(g) SO2Cl2(g) △H <0,设计的制备磺酰氯装置如图-1。
SO2Cl2(g) △H <0,设计的制备磺酰氯装置如图-1。
①若用浓盐酸与二氧化锰为原料制取Cl2,其反应的化学方程式为 。
②有关图-1所示的装置说法正确的是 (不定项选择)。
a.A、E处洗气瓶中盛放的可能分别是饱和食盐水和饱和NaHSO3溶液
b.B处反应管内五球中玻璃棉上的活性炭作催化剂
c.B处反应管冷却水应从m接口通入
d.装置C处吸滤瓶应放在冰水中冷却
e.D处U形管中盛放的可能是碱石灰
③从化学平衡移动角度分析,反应管通水冷却的目的为 。
(4)GET公司开发的Li-SO2Cl2军用电池,其示意图如图-2所示,已知电池反应为:2Li + SO2Cl2 =" 2LiCl" + SO2↑;则电池工作时,正极的电极反应式为 。
钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为:
2Mn2++5S2O82-+8H2O  2MnO4-+10SO42-+16H+
2MnO4-+10SO42-+16H+
(1)基态锰原子的价电子排布式为 。
(2)上述反应涉及的元素属于同主族元素,其第一电离能由大到小的顺序为 (填元素符号)。
(3)已知H2S2O8的结构如图。
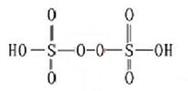
①H2S2O8硫原子的轨道杂化方式为 。
②上述反应中被还原的元素为 。
③上述反应每生成1 mol MnO4-,S2O82- 断裂的共价键类型及其数目为 、 。
(4)一定条件下,水分子间可通过氢键将从H2O分子结合成三维骨架结构,其中的多面体孔穴中可包容气体小分子,形成笼形水合包合物晶体。

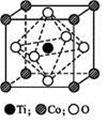
①右图是一种由水分子构成的正十二面体骨架(“o”表示水分子),其包含的氢键数为 ;
②实验测得冰中氢键的作用能为18.8kJ·mol-1,而冰的熔化热为5.0kJ·mol-1,其原因可能是 。
(5)MnO2可用于碱锰电池材料的正极材料,加入某种纳米粉体可以优化碱锰电池的性能,该纳米粉体的结构如右图。该纳米粉体的化学式为__________。
(6)铑(Rh)与钴属于同族元素,性质相似。铑的某配合物的化学式为CsRh(SO4)2·4H2O,该物质易溶于水,向其水溶液中加入一定浓度的BaCl2溶液,无沉淀生成,该盐溶于水的电离方程式为 。
铅及其化合物在工业生产生活中都具有非常广泛的用途。
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
2PbS(s)+3O2(g)=2PbO(s)+2SO2(g)↑H="a" kJ/mol
PbS(s)+2PbO(s)=3Pb(s)+SO2(g)↑H="b" kJ•mol-1
PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g)↑H="c" kJ•mol-1
反应3PbS(s)+6O2(g)=3PbSO4(s)△H=_____________kJ•mol-1(用含a,b,c的代数式表示)。
(2)还原法炼铅,包含反应PbO(s)+CO(g) Pb(s)+CO2(g) △H,该反应的平衡常数的对数值与温度的关系如下表
Pb(s)+CO2(g) △H,该反应的平衡常数的对数值与温度的关系如下表
| 温度 |
300 |
727 |
1227 |
| lgK |
6.17 |
2.87 |
1.24 |
①该还原反应的△H____0(选填:“>”“<”“=”)。
②当lgK=1且起始时只通入CO(PbO足量),达平衡时,混合气体中CO的体积分数为_______。
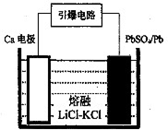
(3)引爆导弹、核武器的工作电源通常Ca/PbSO4热电池,其装置如图所示,该电池正极的电极反应式为_______。
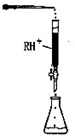
(4)PbI2:可用于人工降雨.取一定量的PbI2固体,用蒸馏水配制成t℃饱和溶液,准确移取25.00mLPbI2饱和溶液分次加入阳离子交换树脂RH+(发生:2RH++PbI2=R2Pb+2H++2I-),用250ml洁净的锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并盛放到锥形瓶中(如图).加入酚酞指示剂,用0.0025mol•L-1NaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL.可计算出t℃时PbI2 Ksp为_______。
(5)铅易造成环境污染,水溶液中的铅存在形态主要有6种,它们与pH关系如图1所示,含铅废水用活性炭进行处理,铅的去除率与pH关系如图2所示.
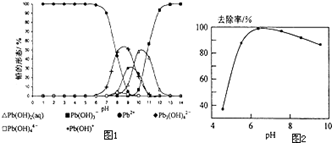
①常温下,pH=6→7时,铅形态间转化的离子方程式为____________________。
②用活性炭处理,铅的去除率较高时,铅主要应该处于________(填铅的一种形态的化学式)形态.
(14分)请回答下列问题:
(1)下表列出了一些化学键的键能E:
| 化学键 |
H—H |
O===O |
O—H |
| E/kJ·mol-1 |
436 |
x |
463 |
反应H2(g)+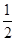 O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1,则x=__________。
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1,则x=__________。
(2)铅蓄电池是正极板上覆盖有PbO2,负极板上覆盖有Pb,电解质溶液是H2SO4溶液,电池放电时的总反应:Pb+PbO2+2H2SO4=2PbSO4+2H2O。
请写出充电时阴极的电极反应式:__________________
(3)反应m A+n B p C,在某温度下达到平衡。
p C,在某温度下达到平衡。
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是________________。
②若C为气体,且m + n = p,在加压时化学平衡发生移动,则平衡必定向________________方向移动。
③若再升高温度,平衡向逆向移动,则正反应为 _________ 反应(填“吸热”或“放热”)
(4)依据氧化还原反应Zn(s)+Cu2+(aq)===Zn2+(aq)+Cu(s)设计的原电池如图所示。

①请在图中标出电极材料及电解质溶液(写化学式)________________
②盐桥中的Cl-向________极移动(填“左”或“右”)。
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:
(1)一定温度下,在一恒容的密闭容器中,由CO和H2合成甲醇:
CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
①下列情形不能说明该反应已达到平衡状态的是 (填序号).
A.每消耗1mol CO的同时生成2molH2
B.混合气体总物质的量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
②CO的平衡转化率(α)与温度、压强的关系如图所示.B、C两点的平衡常数K(B)K(C)(填“>”、“=”或“<”).

③某温度下,将2.0mol CO和6.0molH2充入2L的密闭容器中,达到平衡时测得
c(CO)=0.25mol/L,CO的转化率= ,此温度下的平衡常数K= (保留二位有效数字).
(2)常温下,将V mL、0.20mol/L氢氧化钠溶液逐滴加入到20.00mL、0.20mol/L甲酸溶液中,充分反应,溶液pH=7,此时V 20.00(填“>”、“=”或“<”);当氢氧化钠溶液与甲酸溶液恰好完全反应时,溶液中所含离子浓度由大到小排列顺序____________
(3)温度650℃的熔融盐燃料电池,用(CO、H2)作反应物,空气与CO2的混合气体为正极反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质.该电池的正极反应式为__________ .
(4)己知:CH3OH、H2的燃烧热(△H)分别为﹣726.5kJ/mol、﹣285.8kJ/mol,则常温下CO2和H2反应生成CH3OH和H2O的热化学方程式是 .
(18分)I.碱性锌锰干电池的总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2。该电池中,负极材料是______,正极反应式为_______。
Ⅱ.以废旧锌锰干电池处理得到的混合物为原料制备锰锌铁氧体的主要流程如下图所示。
请回答下列问题:
(1)MnxZn1-xFe2O4中铁元素化合价为+3,则锰元素的化合价为__________。
(2)活性铁粉除汞时,铁粉的作用是_________(填“氧化剂”或“还原剂”)。
(3)除汞是以氮气为载气吹入滤液中,带出汞蒸气经KMnO4溶液进行吸收而实现的。在恒温下不同pH时,KMnO4溶液对Hg的单位时间去除率及主要产物如下图所示。
①写出pH=2时KMnO4溶液吸收汞蒸气的离子方程式_________。
②在强酸性环境中汞的单位时间去除率高,其原因除氢离子浓度增大使KMnO4;溶液的氧化性增强外,还可能是___________。
(4)用惰性电极电解K2MnO4溶液制备KMnO4的装置如图所示。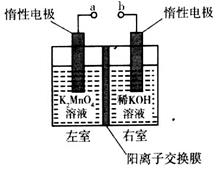
①a应接直流电源的____________(填“正”或“负”)极。
②已知25℃,两室溶液的体积均为100 mL,电解一段时间后,右室溶液的pH由10变为14,则理论上可制得_______mol KMnO4 (忽略溶液的体积和温度变化)。
(14分)CO、SO2是主要的大气污染气体,利用化学反应原理是治理污染的重要方法。
I、甲醇可以补充和部分替代石油燃料,缓解能源紧张。利用CO可以合成甲醇。
(2)一定条件下,在容积为VL的密闭容器中充入α mol CO与2a mol H2合成甲醇平衡转化率与温度、压强的关系如图所示。
①P1__P2(填“>”、“<”或“=”),理由是
②该甲醇合成反应在A点的平衡常数K= (用a和V表示)
③该反应达到平衡时,反应物转化率的关系是:CO H2(填“>” 、“<” 或“="”" )
④下列措施中能够同时满足增大反应速率和提高CO转化率的是 。(填写相应字母)
| A.使用高效催化剂 |
| B.降低反应温度 |
| C.增大体系压强 |
| D.不断将CH30H从反应混合物中分离出来 |
E、增加等物质的量的CO和H2
Ⅱ、某学习小组以SO2为原料,采用电化学方法制取硫酸。
(3)原电池法:该小组设计的原电池原理如图所示。写出该电池负极的电极反应式 。
(4)电解法:该小组用Na2SO3溶液充分吸收S02得到NaHSO3溶液,然后电解该溶液制得了硫酸。原理如下图所示。
写出开始电解时阳极的电极反应式 。
尿素(H2NCONH2)是一种非常重要的高氮化肥,在工农业生产中有着非常重要的地位。
(1)工业上合成尿素的反应如下:
2NH3(l)+CO2(g) H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1
H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1
下列措施中有利于提高尿素的产率的是_________________。
A.采用高温 B.采用高压 C.寻找更高效的催化剂
(2)合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g) H2NCOONH4(氨基甲酸铵) (l) △H1
H2NCOONH4(氨基甲酸铵) (l) △H1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l) △H2
H2O(l)+H2NCONH2(l) △H2
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图Ⅰ所示:
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 步反应决定,总反应进行到 min时到达平衡。
②第二步反应的平衡常数K随温度的变化如上右图Ⅱ所示,则△H2 0(填“>”“<”或“=”)
(3)在温度70—95℃时,工业尾气中的NO、NO2可以用尿素溶液吸收,将其转化为N2
①尿素与NO、NO2三者等物质的量反应,化学方程式为 。
②已知:a :N2(g)+O2(g)= 2NO(g) △H=180.6 kJ·mol—1
b: N2(g)+3H2(g)= 2NH3(g) △H= —92.4kJ·mol—1
c:2H2(g)+O2(g)= 2H2O(g) △H= —483.6 kJ·mol—1
则4NO(g)+4NH3(g)+O2(g)= 4N2(g)+6H2O(g)△H= kJ·mol-1。
(4)尿素燃料电池结构如下图所示。其工作时负极电极反应式可表示为 。