A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的元素。
请用化学用语回答:
(1)推断B元素在元素周期表中的位置 ,写出C的单质的电子式 。
(2)A与D形成的18电子的化合物与FD2化合生成一种强酸,其化学方程式为 。
(3)E、F、G三种元素所形成的简单离子,其离子半径由大到小的顺序是 (用离子符号表示)。
(4)用电子式表示化合物E2F的形成过程 。
(5)下图为某新型发电装置示意图,其负极电极反应为 。
(6)在101 kPa、25℃下,16 g 液态C2A4在D2中完全燃烧生成气体C2,放出312 kJ热量,则C2A4和D2反应的热化学方程式为 。
X、Y、Z、M、G五种元素分属三个短周期, 且原子序数依次增大。X、Z同主族, 可形成离子化合物ZX; Y、M同主族, 可形成MY2、MY3两种分子。请回答下列问题:
(1)Y在元素周期表中的位置为 。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是 (写化学式), 非金属气态氢化物还原性最强的是 (写化学式)。
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有 、 (写出其中两种物质的化学式,一种为单质,另一种为化合物)。
(4)ZX的电子式为 。
(5)熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下图),反应原理为:
2Z+ FeG2 Fe+ 2ZG
Fe+ 2ZG
放电时, 电池的正极反应式为 ,充电时, (写物质名称)电极接电源的负极。
(10分) (Ⅰ)观察图A、B、C,回答下列问题:
(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上有气泡,再平行插入一块铜片,可观察到铜片______(填“有”或“没有”)气泡产生。再用导线把锌片和铜片连接起来(见图A),组成一个原电池,正极的电极反应式为 。
(2)如果烧杯中最初装入的是2mol/L 500mL的稀硫酸溶液,构成铜锌原电池(见图B,假设产生的气体没有损失,锌失去的电子完全沿导线到铜电极),当在标准状况下收集到11.2L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度分别为(溶液体积变化忽略不计) 、 。
(3)如果电极材料分别是铁片和石墨并进行连接,插入氯化钠溶液中(见图C),放置数天后,写出正极的电极反应式 。
(Ⅱ)将铜粉末用10%H2O2和3.0mol•L-1H2SO4混合溶液处埋,测得不同温度下铜的平均溶解速率如下表:
| 温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
| 铜的平均溶解速率 (×10-3mol•L-1·min-1) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
由表中数据可知,当温度高于40℃时,铜的平均溶解速率随着温度的升高而下降,其主要原因是 。
.W、X、Y、Z、M、G六种主族元素分属三个短周期,且原子序数依次增大。Y是地壳中含量最多的元素;M与Y同主族;G与Z形成的化合物是厨房常用的的调味品;X的简单气态氢化物水溶液呈碱性。请回答下列问题:
(1)M在元素周期表中的位置为_________,X的简单气态氢化物的电子式为_____________,W、Y、Z、M、G形成的简单离子的半径大小顺序是___________________(用相应的离子符号表示)。
(2)Y与M的氢化物中,热稳定性更好的是______(填化学式),原因是_______________
(3)由 W、Y、Z、M组成的两种盐(均含有以上四种元素)的溶液反应可产生MY2气体,写出其反应的离子方程式________________________
(4)如图,A、B两极均为惰性电极,a是Z与G形成的饱和溶液,实验开始 时,同时在两边各滴入几滴酚酞试液,则
①电解池中A极上的电极反应式为 。在A极附近观察到的现象是 。
②B电极上的电极反应式为 ,检验该电极反应产物的方法是______________________
(5)最近意大利罗马大学的Funvio Cacace等人获得了极具理论研究意义的X4分子。X4分子结构如下图所示,已知断裂lmolX-X吸收167kJ热量,生成1mo1X2放出942kJ热量。根据以上信息和数据,下列说法正确的是____________。
A.X4沸点比P4(白磷)高,属于原子晶体
B.lmol X4气体转变为X2放出882kJ热量
C.X4与X2互为同素异形体
(6)发射“神六”时用X2W4作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。已知生成1mol水蒸气时放热284kJ,写出X2W4 (g)和NO2(g)反应的热化学方程式__________________,已知H2O(l)==H2O(g) ΔH =+44kJ/mol,则16g X2W4 (g)与NO2反应生成液态水时放出的热量是________kJ。
同时,X2W4可作为新型燃料电池的燃料,在氧气中燃烧生成氮气和水,请利用X2W4、氧气与KOH溶液组成碱性燃料电池,写出该电池负极的电极反应式_______________,指出电解质溶液中OH-离子向________极移动。
下列是构成原电池的实验方案, 请按要求回答下列问题:
(1)电解质溶液为0.5mol·L-1硫酸溶液,电极为用砂纸打磨过的镁片和铝片,设计成原电池,则铝片为
极(填“正”或“负”),正极电极反应式为 ;若将电解质溶液改为0.5mol·L-1氢氧化钠溶液,则被氧化的是 (填“镁片”或“铝片”),该原电池总反应的离子方程式为:
(2)以“Fe+2Fe3+===3Fe2+ ”反应为原理设计原电池,请在以下该原电池装置图括号中写出电极材料及电解质溶液。
(1)已知:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1;
2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) ΔH2,则ΔH1 ΔH2
(2)在298K、100kPa时,已知:
2H2(g)+O2(g)==2H2O(g) ΔH1
2HCl(g)==Cl2(g)+H2(g) ΔH2
4HCl(g)+O2(g)==2Cl2(g)+2H2O(g) ΔH3
则ΔH3与ΔH1和ΔH2的关系是:ΔH3=
(3)消除氮氧化物的污染对环境至关重要,用CH4催化还原NOx可以消除氮氧化物的污染。已知一定条件下:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
则该条件下,用CH4还原NO2至N2的热化学方程式为:
(4)乙烯是石油裂解气的主要成分之一, 25℃、101kPa时,1g乙烯燃烧生成CO2气体与液态水,放出50.5 kJ的热量,该反应的热化学方程式为 __;利用该反应设计为燃料电池中,通入乙烯的电极为电池的________(填“正极”或“负极”)。
(1)请用“>”、“<”或“=”填写下列空格:
①已知:Zn(s)+CuSO4(aq)==ZnSO4(aq)+Cu(s)ΔH="-216" kJ·mol-1,则E反应物 E生成物
②由A、B两金属作电极,硫酸溶液作电解质溶液,形成原电池,电流由A极经外电路流向B极,则金属活泼性A B
③镀层破损后铁的腐蚀速度比较:镀锌铁管 镀锡铁管
(2)用“增大”、“减小”或“不变”填写下列空格:
④以石墨为电极电解Na2SO4溶液时,电解过程中阳极区溶液的pH
⑤某温度下,可逆反应A(s)+ B(g) 2C(g);△H<0,平衡常数为K。其它条件不变时,温度升高,平衡常数K
2C(g);△H<0,平衡常数为K。其它条件不变时,温度升高,平衡常数K
有A、B、C、D四种短周期主族元素,其原子序数依次增大。A、B可形成A2B和A2B2两种共价化合物,B、C同主族且可形成CB2和CB3两种化合物。完成下列问题。
(1)C的名称为________
(2)写出表示非金属性C<D的化学方程式(任一个):________ 。
(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期。该元素可与D形成ED2和ED3两种化合物。将E的单质浸入ED3溶液中,溶液由黄色逐渐变为浅绿色,该反应的离子方程式为______________。
(4)请依据(4)中的反应,设计一个原电池。要求:画出实验装置图,注明电解质溶液名称、正负极及正负极材料,并标出电子移动方向,写出负极反应式。
负极反应式:__________________________________________________________。
分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计。请回答下列问题:
(1)以下叙述中,正确的是__________。
| A.甲中锌片是负极,乙中铜片是正极 |
| B.两烧杯中铜片表面均有气泡产生 |
| C.两烧杯中溶液pH均增大 |
| D.产生气泡的速度甲中比乙中慢 |
E.乙的外电路中电流方向Zn→Cu
(2)变化过程中能量转化的形式主要是:甲为__________;乙为__________。
(3)在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是__________。
(4)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式:_____________
请按要求回答下列问题。
(1)根据下图回答①②。
①打开K2,闭合K1。A极电极反应式为_________________,B极的现象____________。
②B极重新换根碳棒,再打开K1,闭合K2。
B极电极反应式_______________________________。
装置发生的总反应化学方程式______________。实验完成后,锌电极增重a g,则阳极产生标准状况下的气体体积_____ ___L。
(2)改变两电极的电极材料,利用该装置要实现Cu+H2SO4== CuSO4+H2↑反应的发生,应打开____闭合_____,其电解质溶液需用 ,B电极材料是用 ,A电极反应式为 。
A、B、C、X是中学化学常见物质,它们在一定条件下具有如下转化关系:
A + X → B + C + H2O
(1)若X是淀粉水解的最终产物,B为砖红色难溶于水的氧化物。
①X的化学式为 。
②A溶于硝酸的离子方程式为 。
③将淀粉水解液中和后,与A的悬浊液(含NaOH)共热至沸腾,产生砖红色沉淀则证明淀粉已经水解。若要进一步探究淀粉是否完全水解,还需用到的试剂是 。
(2)若A是由M+和R-构成的盐,X为二元强碱,B为气体。
①B与氧气一定条件下可以发生置换反应,当生成18g液态水时,放出能量Q kJ,该反应的热化学方程式为 ;若将该反应设计成燃料电池(以硫酸溶液为电解质溶液),其负极反应式为 。
②室温时,20mL 0.10mol·L-1的B溶液用0.050mol·L-1的硫酸溶液滴定,所得滴定曲线如图所示。曲线上a点,c(M+) c(SO42-)(填“>”、“<”或“=”)。曲线上b点,溶液中c(H+)≈ (只保留一位有效数字)。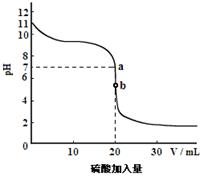
NOx是汽车尾气中的主要污染物之一。
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式: 。
(2)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
①写出该反应的热化学方程式: 。
②随温度升高,该反应化学平衡常数的变化趋势是_ 。
(3)在汽车尾气系统中装置催化转化器,可有效降低NOX的排放。
①当尾气中空气不足时,NOX在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:
_ 。
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOX生成盐。其吸收能力顺序如下:12MgO <20CaO <38SrO<56BaO。原因是 ,元素的金属性逐渐增强,金属氧化物对NOX的吸收能力逐渐增强。
(4)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
①Pt电极上发生的是 反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式: 。
是常见的六种元素。
(1)
位于元素周期表第周期第族。
(2)
的基态原子核外电子排布式为;
的基态原子最外层有个电子。
(3)用">"或"<"填空:
| 原子半径 |
电负性 |
熔点 |
沸点 |
| 金刚石晶体硅 |
|
(4)常温下,将除去表面氧化膜的
、
片插入浓
中组成原电池(图1),测得原电池的电流强度(
)随时间(
)的变化如图2所示,反应过程中有红棕色气体产生。
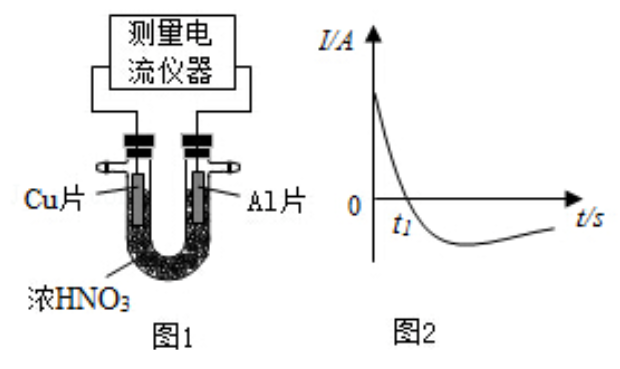
0- 时,原电池的负极是 片,此时,正极的电极反应式是,溶液中的 向极移动, 时,原电池中电子流动方向发生改变,其原因是。
利用生活中或实验室中常用的物品(电极材料、导线、电解质溶液、电流计),根据实验原理:Zn+2H+==Zn2++H2↑,根据选取材料自己动手设计一个原电池。
(1)选取的负极材料为 ,电解液为 :
(2)电子由 极经外电路流向 极(填“正和负”)
(3)负极的电极反应式: 。
(4)正极发生 (“氧化”或“还原”)反应,周围会出现的现象是 。
化学能和电能的相互转化,是能量转化的重要方式之一,如图两个实验装置是实现化学能和电能相互转化的装置。
(1)把化学能转化为电能的装置是 (填“甲”或“乙”);
(2)甲中②的电极名称为 。
(3)④电极上的电极反应式为 。
(4)①电极上的电极反应式为 ,
检验该电极反应产物的方法是 。
(5)写出装置甲的反应总化学方程式 。