空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。RFC工作原理如图所示,下列有关说法正确的是
A.当有0.1mol电子转移时,a电极产生2.24LH2
B.b极上发生的电极反应是:4H2O+4e- =2H2↑+4OH-
C.c极上进行还原反应,B池中的H+可以通过隔膜进入A 池
D.d电极上发生的电极反应是:O2+4H++4e-=2H2O
如图所示,其中甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O.下列说法正确的是
| A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置 |
| B.甲池通入CH3OH的电极反应为CH3OH-6e-+2H2O=CO32-+8H+ |
| C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度 |
| D.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体 |
碱性硼化钒(VB2)—空气电池工作时反应为:4VB2 + 11O2 = 4B2O3 + 2V2O5。用该电池为电源, 选用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是

| A.电解过程中,c电极表面先有红色物质析出,后有气泡产生 |
| B.外电路中电子由c电极流向VB2电极 |
| C.VB2电极发生的电极反应为: 2VB2 + 11H2O - 22e- = V2O5 + 2B2O3 + 22H+ |
| D.若B装置内的液体体积为100 mL,则CuSO4溶液的物质的量浓度为0.05 mol/L |
关于如图所示的原电池,下列说法正确的是( )
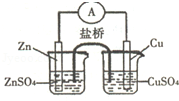
| A.电子从锌电极通过电流表流向铜电极 |
| B.盐桥中的阴离子向硫酸铜溶液中迁移 |
| C.取出盐桥后,电流计的指针仍发生偏转 |
| D.铜电极上发生的电极反应是2H++2e﹣═H2↑ |
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列有关说法正确的是
| A.正极反应式:Ca+2Cl--2e-=CaCl2 |
| B.放电过程中,Li+向负极移动 |
| C.常温时,在正负极间接上电流表或检流计,指针发生偏转 |
| D.每转移0.1 mol电子,理论上生成10.35 g Pb |
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列有关说法正确的是
| A.正极反应式:Ca+2Cl--2e-=CaCl2 |
| B.放电过程中,Li+向负极移动 |
| C.常温时,在正负极间接上电流表或检流计,指针发生偏转 |
| D.每转移0.1 mol电子,理论上生成10.35 g Pb |
控制适合的条件,将反应2Fe3++2I- 2Fe2++I2设计成如图所示的原电池。下列判断不正确的是( )
2Fe2++I2设计成如图所示的原电池。下列判断不正确的是( )
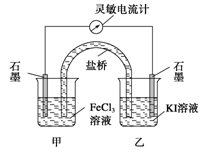
| A.反应开始时,乙中石墨电极上发生氧化反应 |
| B.反应开始时,甲中石墨电极上的Fe3+被还原 |
| C.电流计读数为零时,反应达到化学平衡状态 |
| D.电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极 |
对于原电池的电极名称,叙述有错误的是:
| A.发生氧化反应的极为负极 | B.正极为电子流入的一极 |
| C.比较不活泼的金属为负极 | D.电势较高的一极为正极 |
市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li的高分子材料。这种锂离子电池的电池反应为: Li+2Li0.35NiO2 2Li0.85NiO2 ,下列说法不正确的是( )
2Li0.85NiO2 ,下列说法不正确的是( )
| A.放电时,负极的电极反应式:Li-e-=Li+ |
| B.充电时,Li0.85NiO2既发生氧化反应又发生还原反应 |
| C.该电池不能用水溶液作为电解质 |
| D.放电过程中Li+向负极移动 |
锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是
| A.铜电极上发生氧化反应 |
| B.电池工作一段时间后,甲池的c(SO)减小 |
| C.电池工作一段时间后,乙池溶液的总质量增加 |
| D.阴阳离子分别通过交换膜向负极和正极移动, |
保持溶液中电荷平衡
如图所示,甲池的总反应式为2CH3OH+3O2+4KOH===2K2CO3+6H2O。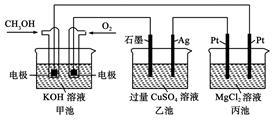
下列说法正确的是
| A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化为电能的装置 |
| B.甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O===CO32-+8H+ |
| C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度 |
| D.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上产生1.45 g固体 |
以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如右图。下列说法正确的是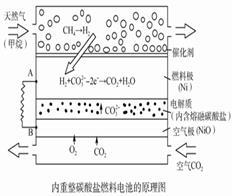
| A.以此电池为电源电解精炼铜,当有0.1 mol e- 转移时,有3.2 g铜溶解 |
| B.若以甲烷为燃料气时负极电极反应式:CH4+5O2--8e-=CO32-+2H2O |
| C.该电池使用过程中需补充Li2CO3和K2CO3 |
| D.空气极发生的电极反应式为O2+4e-+2CO2===2CO32- |
对原电池的电极名称,下列叙述中错误的是
| A.电子流入的一极为正极 |
| B.比较不活泼的一极为正极 |
| C.电子流出的一极为负极 |
| D.发生氧化反应的一极为正极 |