在盛有稀H2SO4的烧杯中放入导线连接的锌片和铜片,下列叙述正确的是( )
| A.正极附近的SO42-离子浓度逐渐增大 |
| B.电子通过导线由铜片流向锌片 |
| C.正极有O2逸出 |
| D.铜片上有H2逸出 |
利用右图装置,完成很多电化学实验。下列有关此装置的叙述中,不正确的是 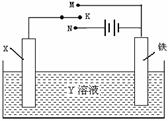
| A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极的阴极保护法 |
| B.若X为碳棒,Y为饱和NaOH溶液,开关K置于N处,保持温度不变,则溶液的pH保持不变 |
| C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动 |
| D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,铁棒质量将增加,溶液中铜离子浓度将减小 |
用下图Ⅰ所示装置通电10分钟后,去掉直流电源,连接成图Ⅱ所示装置,可观察到U形管左端铁电极表面析出白色胶状物质,U形管右端液面上升。下列说法正确的是 
| A.同温、同压下,装置Ⅰ中石墨电极上方得到的气体比铁电极上方得到的气体多 |
| B.用装置Ⅱ进行实验时铁电极的电极反应为Fe-2e-+2OH-===Fe(OH)2 |
| C.用装置Ⅱ进行实验时石墨电极的电极反应为2H++2e-===H2↑ |
| D.装置Ⅰ通电10分钟后铁电极周围溶液pH降低 |
我国知名企业比亚迪公司开发了具有多项专利的锂钒氧化物二次电池,其成本较低,对环境无污染,能量密度远远高于其它材料电池,电池总反应为:V2O5+xLi  LixV2O5。下列说法中,正确的是 ( )
LixV2O5。下列说法中,正确的是 ( )
| A.锂在放电时做正极材料,充电时为阳极材料 |
| B.电池在放电时,Li+向负极移动 |
| C.该电池充电时阳极的反应为:LixV2O5 -xe-=V2O5 + xLi+ |
| D.V2O5只是锂发生反应的载体,不参与电池反应 |
如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是 
| A.a为负极,是铁片,烧杯中的溶液为硫酸 |
| B.b为负极,是铁片,烧杯中的溶液为硫酸铜溶液 |
| C.a为正极,是碳棒,烧杯中的溶液为硫酸 |
| D.b为正极,是碳棒,烧杯中的溶液为硫酸铜溶液 |
下列反应中,在原理上可以设计成原电池的是
| A.Ba(OH)2·8H2O与NH4Cl的反应 | B.铝片与浓硫酸的反应 |
| C.甲烷与氧气的反应 | D.石灰石的分解反应 |
关于如图所示装置的叙述,正确的是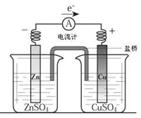
| A.铜是阳极,铜片上有气泡产生 |
| B.铜片质量逐渐减少 |
| C.电流从锌片经导线流向铜片 |
| D.铜离子在铜片表面被还原 |
某金属能跟稀盐酸作用放出氢气,该金属与锌组成原电池时,锌为负极,此金属是
| A.铁 | B.铜 | C.铝 | D.镁 |
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
| A.两烧杯中铜片表面均无气泡产生 |
| B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的pH均增大 |
| D.产生气泡的速度甲比乙慢 |
以惰性电极电解CuSO4溶液。若阳极上产生气体的物质的量为0.010 mol,则阴极上析出Cu的质量为
| A.0.64 g | B.5.12 g | C.2.56 g | D.1.28 g |
下列说法正确的是
| A.牺牲阴极的阳极保护法是应用电解原理防止金属的腐蚀 |
| B.CO的标准燃烧热是283.0 kJ·mol-1,则2CO2(g) =2CO(g)+O2(g)反应的 ΔH=+566.0 kJ·mol-1 |
| C.一个反应能否自发进行取决于该反应是放热还是吸热 |
| D.用洁净玻璃棒蘸取某溶液点在湿润的pH试纸上,与标准比色卡对比即可测定该溶液pH |
对铜—锌—稀硫酸组成的原电池装置中,当导线中有1mol电子通过时,理论上的两极变化是( )
①锌片溶解了32.5克 ②锌片增重了32.5克 ③铜片上析出1克氢气
④铜片上析出1mol氢气
| A.①③ | B.①④ | C.②③ | D.②④ |