(18分)I.碱性锌锰干电池的总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2。该电池中,负极材料是______,正极反应式为_______。
Ⅱ.以废旧锌锰干电池处理得到的混合物为原料制备锰锌铁氧体的主要流程如下图所示。
请回答下列问题:
(1)MnxZn1-xFe2O4中铁元素化合价为+3,则锰元素的化合价为__________。
(2)活性铁粉除汞时,铁粉的作用是_________(填“氧化剂”或“还原剂”)。
(3)除汞是以氮气为载气吹入滤液中,带出汞蒸气经KMnO4溶液进行吸收而实现的。在恒温下不同pH时,KMnO4溶液对Hg的单位时间去除率及主要产物如下图所示。
①写出pH=2时KMnO4溶液吸收汞蒸气的离子方程式_________。
②在强酸性环境中汞的单位时间去除率高,其原因除氢离子浓度增大使KMnO4;溶液的氧化性增强外,还可能是___________。
(4)用惰性电极电解K2MnO4溶液制备KMnO4的装置如图所示。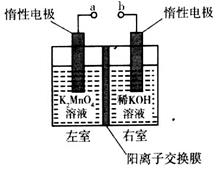
①a应接直流电源的____________(填“正”或“负”)极。
②已知25℃,两室溶液的体积均为100 mL,电解一段时间后,右室溶液的pH由10变为14,则理论上可制得_______mol KMnO4 (忽略溶液的体积和温度变化)。
(共14分)(1)美国麻省理工学院(MIT)近年来设计出镁锑液态金属电池,其工作原理如图所示,负极金属失去电子,并通过外电路做功,而负极金属离子化后通过熔盐迁移到正极并与正极金属合金化;充电则执行相反的过程。
写出电池放电时的正极反应式为 。
(2)我国锑的蕴藏量占世界第一位,辉锑矿(Sb2S3)是其主要矿物。某冶金课题组进行三氯化锑水溶液的电解研究,然后利用电解过程中阳极生成的五氯化锑作为浸出剂,对辉锑矿进行酸性浸出;从而实现浸出-电解的闭路循环,解决了传统炼锑过程中“工业三废”排放量大的问题。流程如图:
①写出锑元素在周期表中的位置 。
②“工业三废”指的是 。
③电解过程中阳极主要是Sb3+被氧化成Sb5+。请写出阴极的电极反应式 。
④根据流程图写出“浸出”步骤发生反应的化学方程式 。
⑤已知浸出液中除Sb3+外,还有Cu2+、Pb2+等重金属离子,其中c(Cu2+)=1.6×10-3mol·L-1,向浸出液中加入硫化钠至溶液中的Cu2+刚好完全沉淀,则c(S2-)= 。(已知Ksp(CuS)=8×10-45 Ksp(PbS)=3.4×10-28)
⑥还原除砷的原理是:在大于4mol·L-1的HCl溶液中,以次磷酸钠(Na3PO2)做还原剂,保持微沸温度,使AsCl3被还原为棕色单质砷沉淀,请配平该反应的化学方程式:
AsCl3 + Na3PO2 + HCl + H2O = As ↓+ H3PO3 + NaCl
(14分)请回答下列问题:
(1)下表列出了一些化学键的键能E:
| 化学键 |
H—H |
O===O |
O—H |
| E/kJ·mol-1 |
436 |
x |
463 |
反应H2(g)+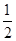 O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1,则x=__________。
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1,则x=__________。
(2)铅蓄电池是正极板上覆盖有PbO2,负极板上覆盖有Pb,电解质溶液是H2SO4溶液,电池放电时的总反应:Pb+PbO2+2H2SO4=2PbSO4+2H2O。
请写出充电时阴极的电极反应式:
(3)反应m A+n B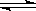 p C,在某温度下达到平衡。
p C,在某温度下达到平衡。
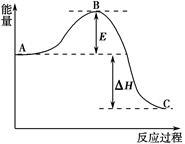
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是_______。
②若C为气体,且m + n = p,在加压时化学平衡发生移动,则平衡必定向_______方向移动。
③若再升高温度,平衡向逆向移动,则正反应为 反应(填“吸热”或“放热”)
(4)依据氧化还原反应Zn(s)+Cu2+(aq)===Zn2+(aq)+Cu(s)设计的原电池如图所示。
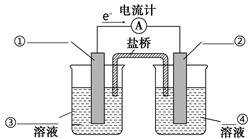
①请在图中标出电极材料及电解质溶液(写化学式)
②盐桥中的Cl-向________极移动(填“左”或“右”)。
(14分,每空2分))镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下: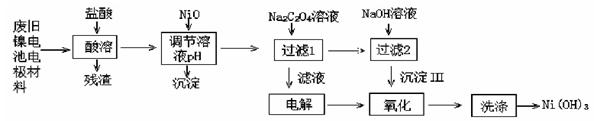
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4> NiC2O4·H2O > NiC2O4·2H2O
③Ksp[Ni(OH)2]=5.0×10-16, Ksp(NiC2O4)=5.0×10-10;
回答下列问题:
(1)酸溶后所留残渣的主要成分为 (填物质名称)。
(2)用NiO调节溶液的pH,析出沉淀的成分为 (填化学式)。
(3)写出加入Na2C2O4溶液后反应的化学方程式: 。
(4)写出加入NaOH溶液所发生反应的离子方程式: 。
(5)电解过程中阴极反应式 ,沉淀Ⅲ可被电解所得产物之一氧化,写出氧化反应的离子方程式 。
(6)铁镍蓄电池,放电时总反应为:
Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是
| A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe |
| B.电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2 |
| C.电池充电过程中,阴极附近溶液的pH降低 |
| D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O |
附加题:(共10分)铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层,则 PbO2的酸性比CO2的酸性 (填“强”或“弱”)。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为 。
(3)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
①2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) △H=" a" kJ·mol-1
②PbS(s)+2PbO(s)=3Pb(s)+SO2(g) △H=" b" kJ·mol-1
③PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) △H=" c" kJ·mol-1
反应3PbS(s)+ 6O2(g)=3PbSO4(s) ΔH= kJ ·mol-1(用含a,b ,c的代数式表示)。
(4)引爆导弹、核武器的工作电源通常Ca/PbSO4热电池,其装置如图所示,该电池正极的电极反应式为 。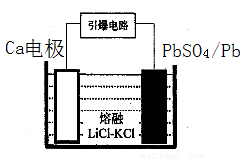
(5)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重4.0%(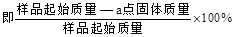 )的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,则计算x= _和m:n=_ _。
)的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,则计算x= _和m:n=_ _。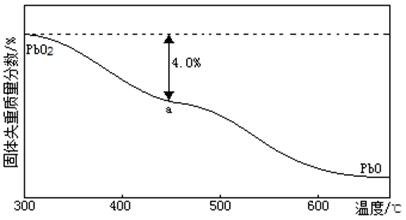
铜在工农业生产中有着广泛的用途。
(1)配制CuSO4溶液时需加入少量稀H2SO4,其原因是 (只写离子方程式)。
(2)某同学利用制得的CuSO4溶液,进行以下实验探究。
①图甲是根据反应Fe+CuSO4=Cu+FeSO4设计成铁铜原电池,请图甲中的横线上完成标注。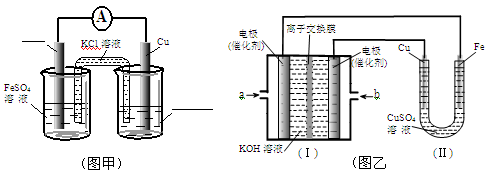
②图乙中,I是甲烷燃料电池的示意图,该同学想在II中实现铁上镀铜,则应在a处通入 (填“CH4”或“O2”),b处电极上发生的电极反应式为 ==4OH-;
若把II中电极均换为惰性电极,电解液换为含有0.1molNaCl溶液400mL,当阳极产生的气体为448mL(标准状况下)时,溶液的pH= (假设溶液体积变化忽略不计)。
(3)电池生产工业废水中常含有毒的Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去[室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2]。请结合离子方程式说明上述除杂的原理:当把FeS加入工业废水中后,直至FeS全部转化为CuS沉淀,从而除去溶液中Cu2+。
(14分)以硫铁矿(主要成分为FeS2)为原料制取硫酸,其烧渣可用来炼铁。
(1)煅烧硫铁矿时发生反应:FeS2+O2―→Fe2O3+SO2(未配平)。当产生448 L(标准状况)SO2时,消耗O2的物质的量为____________。
(2)Fe2O3用CO还原焙烧的过程中,反应物、生成物和温度之间的关系如图所示。

(图中Ⅰ、Ⅱ、Ⅲ、Ⅳ四条曲线是四个化学反应平衡时的气相组成对温度作图得到的;A、B、C、D四个区域分别是Fe2O3、Fe3O4、FeO、Fe稳定存在的区域)
已知:3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g);ΔH1=a kJ·mol-1
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g);ΔH2=b kJ·mol-1
FeO(s)+CO(g)===Fe(s)+CO2(g);ΔH3=c kJ·mol-1
① 反应Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g)的ΔH=____________kJ·mol-1(用含a、b、c的代数式表示)。
②800 ℃时,混合气体中CO2体积分数为40%时,Fe2O3用CO还原焙烧反应的化学方程式为__________________。
③ 据图分析,下列说法正确的是___________ (填字母)。
a. 温度低于570℃时,Fe2O3还原焙烧的产物中不含FeO
b. 温度越高,Fe2O3还原焙烧得到的固体物质组成中Fe元素的质量分数越高
c. Fe2O3还原焙烧过程中及时除去CO2有利于提高Fe的产率
(3) FeS2是Li/FeS2电池(示意图如图)的正极活性物质。
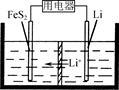
①FeSO4、Na2S2O3、S及H2O在200 ℃时以等物质的量连续反应24 h后得到FeS2。写出该反应的离子方程式: 。
②Li/FeS2电池的负极是金属Li,电解液是含锂盐的有机溶液。电池放电反应为FeS2+4Li===Fe+4Li++2S2-。该反应可认为分两步进行:第1步,FeS2+2Li===2Li++FeS22-,则第2步正极的电极反应式为____________________。
10分)下图是一个化学过程的示意图
回答下列问题:
(1)甲池是 装置,电极A的名称是 。
(2)甲装置中通入CH4的电极反应式为 ,
乙装置中B(Ag)的电极反应式为 ,
丙装置中D极的产物是 (写化学式),
(3)一段时间,当丙池中产生112mL(标准状况下)气体,若要使丙池恢复电解前的状态,
应向丙池中 (写化学式)。
思考下列问题,按要求填空:
(1)某温度下纯水中c(H+) = 2×10-7 mol/L
①此时溶液中的C(OH-) = ___ __。
②若温度不变,向水中滴入稀盐酸使c (H+) = 5×10-6 mol/L,则此时溶液中的C(OH-) =___ __。
(2)已知下列热化学方程式:Zn(s)+ O2(g)="==ZnO(s)" △H1="-351.1" kJ·mol-1;
O2(g)="==ZnO(s)" △H1="-351.1" kJ·mol-1;
Hg(l)+ O2(g)="==HgO(s)" △H2="-90.7" kJ·mol-1
O2(g)="==HgO(s)" △H2="-90.7" kJ·mol-1
由此可知反应Zn(s)+HgO(s)===ZnO(s)+Hg(l)的焓变为___ __。
(3)在稀氨水中存在下述电离平衡NH3+H2O  NH3 ·H2O
NH3 ·H2O  NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?___ __(填“增大”、“减小”或“不变”);平衡移动方向如何?___ __(填“正向”、“逆向”或“不移动”)。
NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?___ __(填“增大”、“减小”或“不变”);平衡移动方向如何?___ __(填“正向”、“逆向”或“不移动”)。
| 加入的物质 |
少量(NH4)2SO4固体 |
少量HNO3溶液 |
少量KOH溶液 |
| c(OH-)的变化 |
|
减小 |
|
| 平衡移动方向 |
逆向 |
|
逆向 |
(4)如图所示,装置B中两电极均为石墨电极,试回答下列问题:
①判断装置的名称:A池为____ ____。
②锌极为___ ___极,电极反应式为_____ _______;
③当C2极析出224 mL气体(标准状况下),锌的质量减少_ _g
钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为:
2Mn2++5S2O82-+8H2O  2MnO4-+10SO42-+16H+
2MnO4-+10SO42-+16H+
(1)基态锰原子的价电子排布式为 。
(2)上述反应涉及的元素属于同主族元素,其第一电离能由大到小的顺序为 (填元素符号)。
(3)已知H2S2O8的结构如图。
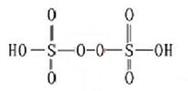
①H2S2O8硫原子的轨道杂化方式为 。
②上述反应中被还原的元素为 。
③上述反应每生成1 mol MnO4-,S2O82- 断裂的共价键类型及其数目为 、 。
(4)一定条件下,水分子间可通过氢键将从H2O分子结合成三维骨架结构,其中的多面体孔穴中可包容气体小分子,形成笼形水合包合物晶体。

①右图是一种由水分子构成的正十二面体骨架(“o”表示水分子),其包含的氢键数为 ;
②实验测得冰中氢键的作用能为18.8kJ·mol-1,而冰的熔化热为5.0kJ·mol-1,其原因可能是 。
(5)MnO2可用于碱锰电池材料的正极材料,加入某种纳米粉体可以优化碱锰电池的性能,该纳米粉体的结构如右图。该纳米粉体的化学式为__________。
(6)铑(Rh)与钴属于同族元素,性质相似。铑的某配合物的化学式为CsRh(SO4)2·4H2O,该物质易溶于水,向其水溶液中加入一定浓度的BaCl2溶液,无沉淀生成,该盐溶于水的电离方程式为 。
I.下图为相互串联的三个装置,试回答: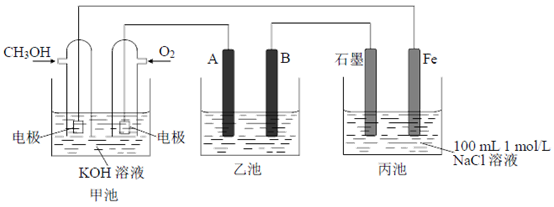
(1)若利用乙池在铁片上镀银,则B是_________(填电极材料),电极反应式是_________;应选用的电解质溶液是_____________。
(2)若利用乙池进行粗铜的电解精炼,则________极(填“A”或“B”)是粗铜,若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为_____________________。
(3)丙池滴入少量酚酞试液,电解一段时间___________(填“C”或“Fe”)极附近呈红色。
(4)写出甲池负极的电极反应式:________________________________。若甲池消耗3.2gCH3OH气体,则丙池中阳极上放出的气体物质的量为______________。
II.(5)请利用反应Fe +2Fe3+= 3Fe2+设计原电池。
设计要求:①该装置尽可能提高化学能转化为电能的效率;
②材料及电解质溶液自选,在图中做必要标注;
③画出电子的转移方向。
Ⅰ.A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的元素.请用化学用语回答:
(1)推断B元素在元素周期表中的位置_______________________。
(2)A与D形成的18电子的化合物与FD2化合生成一种强酸,其化学方程式为_____________。
(3)用电子式表示化合物E2F的形成过程_______________________。
(4)下图为某新型发电装置示意图,其负极电极反应为_______________________。

(5)在101kPa、25℃下,16g液态C2A4在D2中完全燃烧生成气体C2,放出312kJ热量,则C2A4和D2反应的热化学方程式为_______________________。
Ⅱ.A、B、C、X均为常见的纯净物,它们之间有如下转化关系(副产品已略去)。
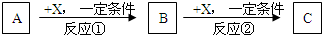
试回答:
(1)若X是强氧化性单质,则A不可能是___________。
a.S b.N2 c.Na d.Mg e.Al
(2)若X是金属单质,向C的水溶液中滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的 化 学式为___________。
(3)若A、B、C为含某金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为___________。
金属铁是应用广泛,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可利用离子交换和滴定的方法。实验中称取3.25g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用1.0 mol·L-1的盐酸中和滴定,正好中和时消耗盐酸60.0mL。计算该样品中氯的物质的量,并求出FeClx中x的值:
(列出计算过程)。
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl) = 1∶2.8,则该样品中FeCl3的物质的量分数为 。
(3)把SO2气体通入FeCl3溶液中,发生反应的离子方程式为 。
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为 ;与MnO2—Zn电池类似,K2FeO4—Zn也可以组成碱性电池,其中Zn极的电极反应式为 ,K2FeO4的电极反应式为 。
美国斯坦福大学研究人员最近发明一种“水”电池,这种电池能利用淡水与海水之间含盐量的差别进行发电。海水中的“水”电池总反应可表示为:5MnO2 + 2Ag + 2NaCl=Na2Mn5O10 + 2AgCl
(1)写出负极电极反应式 。
(2)当生1 mol Na2Mn5O10时,转移电子的数目是 。
用上述电池电解尿素[CO(NH2)2]的碱性溶液制合成氨的装置如图(隔膜仅阻止气体通过,阴、阳极均为惰性电极)。

(3)写出A电极的名称 。
(4)写出电解时阳极的电极反应式 。
(5)已知电解排出液中n(OH-)/n(CO32-) =1,则起始时进入电解池中的原料配比n(KOH)/n[CO(NH2)2]是 。
(原创)化学反应原理在生产和科研中有着重要的应用,请利用相关知识回答下列问题。
(1)一定条件下在密闭容器中加入NH4I发生反应:
a.NH4I(s)  NH3(g)+HI(g)
NH3(g)+HI(g)
b.2HI(g)  H2(g)+I2(g)
H2(g)+I2(g)
则反应a的平衡常数表达式为_______;达到平衡后,扩大容器体积,反应b的移动方向_______(填正向、逆向或不移动)
(2)氮元素的+4价氧化物有两种,它们之间发生反应:2NO2 N2O4△H < 0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是_____________
N2O4△H < 0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是_____________
| A.b点的操作是压缩注射器 |
| B.c点与a点相比,c(NO2)增大,c(N2O4)减小 |
| C.若反应在一绝热容器中进行,则b、c两点的平衡常数Kb>Kc |
D.d点: (正)> (正)>  (逆) (逆) |
(3)利用反应6NO2+8NH3=7N2+12H2O构成原电池,能消除氮氧化物的排放,减轻环境污染,装置如图所示。
①电极a为______极,其电极反应式为________________
②当有2.24 L NO2(标准状况下)被处理时,转移电子为____________mol
③为使电池持续放电,该离子交换膜需选用_______(选填“阳”或“阴”)离子交换膜。
(4)使用硼氢化钠(NaBH4)为诱导剂,可使Co2+与肼(N2H4)在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
①写出该反应的离子方程式______________________________。
②在纳米钴的催化作用下,肼(N2H4)可分解生成两种气体,其中一种气体能使湿润的红色石蕊试纸变蓝。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示,为抑制肼的分解,可采取的合理措施有_________________________________ (任写一种)。