一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是()
| A. |
|
| B. |
|
| C. |
|
| D. |
|
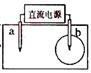
根据下图,下列判断中正确的是( )
| A.烧杯a中的溶液pH升高 |
| B.烧杯b中发生氧化反应 |
| C.烧杯a中发生的反应为2H++2e-=H2 |
| D.烧杯b中发生的反应为2Cl--2e-=Cl2 |
取一张用饱和的溶液浸湿的
试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现
电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色。则下列说法错误的是( )
| A. |
|
B. |
|
| C. | 电解过程中水是氧化剂 | D. |
|
(1)家用液化石油气的主要成分之一是丁烷(C4H10),当10 kg丁烷完全燃烧并生成二氧化碳气体和液态水时,放出的热量为5×105 kJ。试写出丁烷燃烧的热化学方程式:
。
已知1mol液态水汽化时需要吸收44 kJ热量,则1mol丁烷完全燃烧生成二氧化碳气体和气态水时,放出的热量为 kJ。
(2)有同学制作一氢氧燃烧电池,通入H2的一极为 极。若以稀硫酸为电解质溶液时,其正极反应式为 。
液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料 的电池装置如图所示,该电池以空气中的氧气为氧化剂,以 KOH 溶液为电解质溶液.下列关于该电池的叙述错误的是( )
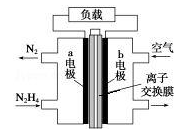
| A.b 极发生还原反应 | |
B.a 极的反应式为 N2H4﹣4e﹣═N2↑+4H+ |
C.放电时,电流从 b 极经过负载流向 a 极 |
| D.其中的离子交换膜需选用阴离子交换膜 |
下列四个装置图均与电化学有关,请根据图示回答相关问题:
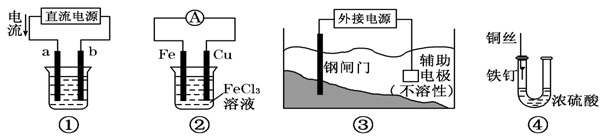
(1)这四个装置中,利用电解原理的是 (填装置序号);
(2)装置①若用来精炼铜,则a极的电极材料是 (填“粗铜”或“精铜”),电解质溶液为 ;
(3)装置②的总反应方程式是 ;
(4)装置③中钢闸门应与外接电源的 极相连(填“正”或“负”)
(5)装置④中的铁钉几乎没被腐蚀,其原因是 。
据报道,我国拥有完全自主产权的氢氧燃料电池车已在北京奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液。下列有关该电池的叙述不正确的是
| A.正极反应式为:O2+2H2O+4e-=4OH- |
| B.工作一段时间后,电解液中KOH的物质的量不变 |
| C.该燃料电池的总反应方程式为:2H2+O2=2H2O |
| D.该电池工作时每消耗1 mol O2,有2 mol电子转移 |
下列说法正确的是
| A.润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从上口倒出,重复2~3次 |
B.用惰性电极电解MgCl2溶液的离子方程式为:2Cl-+ 2H2O Cl2↑+ H2↑+ 2OH- Cl2↑+ H2↑+ 2OH- |
| C.为验证盐桥的作用,在两个烧杯中分别盛适量硫酸亚铁铵溶液和稀酸性高锰酸钾溶液,分别插入石墨棒用导线与电流计相连,然后用装有K2SO4饱和溶液的琼脂的U型管两端插入两个烧杯中,电流计偏转,一段时间后高锰酸钾溶液褪色 |
| D.嫦娥三号月球车玉兔号在进入第二个月夜休眠前,出现了机构控制异常情况,其病因或为月尘,即月球上直径小于10微米的浮尘,月尘分散在空气中形成的分散系属于胶体。 |
下列各变化中属于原电池反应的是( )。
| A.在空气中金属铝表面迅速氧化形成保护层 |
| B.镀锌铁表面有划损时,仍然能阻止铁被氧化 |
| C.红热的铁丝与冷水接触,表面形成蓝黑色保护层 |
| D.锌与稀硫酸反应时,加入少量CuSO4溶液可使反应加快 |
—种直接肼燃料电池的结构如图所示,下列说法正确的是
| A.a极为电池的正极 |
| B.电路中每转移6.02X1023个电子,则有1molNa+穿过膜向正极移动 |
C.b极的电极反应式为H202+2e- 20H- 20H- |
| D.用该电池电解饱和食盐水,当阳极生成2.24 L(标准状况)Cl2时,消耗肼0.1 mol |
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O Cd(OH)2 + 2Ni(OH)2 有关该电池的说法正确的是( )
Cd(OH)2 + 2Ni(OH)2 有关该电池的说法正确的是( )
| A.充电时阳极反应:Ni(OH)2-e- + OH-=NiOOH + H2O |
| B.充电过程是化学能转化为电能的过程 |
| C.放电时负极附近溶液的碱性不变 |
| D.放电时电解质溶液中的OH-向正极移动 |
下列实验操作、现象和结论均正确的是
| 选项 |
操作 |
现象 |
结论 |
| A |
将饱和FeCl3溶液滴入沸水中 |
溶液变红褐色 |
有Fe(OH)3生成 |
| B |
向Na2S溶液中滴加盐酸 |
产生气泡 |
Cl的非金属性比S强 |
| C |
向溶液中滴加盐酸酸化的BaCl2溶液 |
产生白色沉淀 |
溶液中含有SO42- |
| D |
用导线连接铜片和锌片后插进盐酸中 |
铜片上有气泡 |
铜片是原电池的正极 |
如图所示,甲、乙两装置电极材料都是铁棒与碳棒,请回答下列问题:
(1)若两装置中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲装置中的________棒,乙装置中的________棒。
②乙装置中阳极的电极反应式是:_______________________________。
(2)若两装置中均为饱和NaCl溶液:
①写出乙装置中总反应的离子方程式:__________________________________。
②甲装置中碳极的电极反应式是___________ _______,乙装置碳极的电极反应属于________(填“氧化反应”或“还原反应”)。
③将湿润的淀粉KI试纸放在乙装置碳极附近,发现试纸变蓝,解释其原因:
_______________________________________________________________________。
电化学在日常生活中用途广泛,图①是镁次氯酸钠燃料电池,电池总反应为Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图②是Cr2O72-的工业废水的处理。下列说法正确的是( )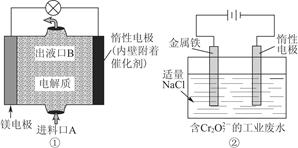
| A.图②中Cr2O72-向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去 |
| B.图②的电解池中,有0.084 g阳极材料参与反应,阴极会有336 mL的气体产生 |
| C.图①中发生的还原反应是Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓ |
| D.若图①中3.6 g镁溶解产生的电量用于图②废水处理,理论可产生10.7 g氢氧化铁沉淀 |