某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见下图,
电池总反应可表示为:2H2+O2===2H2O,下列有关说法正确的是
| A.电子通过外电路从b极流向a极 |
| B.b极上的电极反应式为:O2+2H2O+4e-===4OH- |
| C.每转移0.1 mol电子,消耗标准下1.12 L的H2 |
| D.H+由b极通过固体酸电解质传递到a极 |
随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因是
| A.利用电池外壳的金属材料 |
| B.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染 |
| C.不使电池中渗泻的电解液腐蚀其他物品 |
| D.回收其中石墨电极 |
关于如图所示装置的叙述,正确的是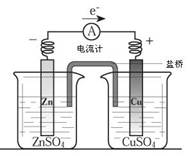
| A.铜是阳极,铜片上有气泡产生 |
| B.铜片质量逐渐减少 |
| C.电流从锌片经导线流向铜 |
| D.铜离子在铜片表面被还原 |
对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法不正确的是
| A.Zn是负极 | B.Cu是正极 |
| C.负极上发生氧化反应 | D.正极上发生氧化反应 |
有关下图装置的说法中正确的是
| A.若两电极直接连接,a是食盐水,则发生析氢腐蚀 |
| B.若铁接电源负极,石墨接电源正极,a是稀H2SO4溶液,电解一段时间后溶液的pH增大 |
| C.若两电极直接连接,则电子从铁流向石墨 |
| D.若铁接电源正极,石墨接电源负极,a是氯化铜溶液,阴离子向石墨电极移动 |
关于如图所示装置的叙述,正确的是
| A.铜是阳极,铜片上有气泡产生 |
| B.铜片质量逐渐减少 |
| C.电流从锌片经导线流向铜片 |
| D.氢离子在铜片表面被还原 |
下列有关说法中不正确的是
| A.将SO2通入BaCl2溶液中至饱和,无沉淀产生,再通入过量NH3,产生沉淀 |
| B.高纯硅常用作光导纤维的原料 |
| C.用AlCl3溶液制取Al(OH)3,沉淀剂选用氨水比选用NaOH溶液好 |
| D.纯锌与稀硫酸反应产生氢气的速率较慢,再加入少量CuSO4固体,反应速率加快 |
有关如下图所示原电池的叙述,正确的是:( )(盐桥中装有KCl饱和溶液)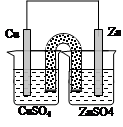
| A.铜片上有气泡逸出 |
| B.取出盐桥后,电流计依然发生偏转 |
| C.反应中,盐桥中的K+会移向CuSO4溶液 |
| D.反应前后铜片质量不改变 |
将铜纳米颗粒和银纳米颗粒相隔一定距离固定在石墨片上,然后浸在AgNO3溶液中,可构成一种纳米型原电池。该电池负极发生的反应为
| A.Ag+ + e—===Ag | B.Cu — 2e—===Cu2+ |
| C.Cu2+ + 2e—===Cu | D.2H+ + 2e—===H2↑ |
关于下图电化学装置中的电极名称、材料及反应均可能正确的是
| A.阴极(Cu片)2C1――2e-=Cl2↑ |
| B.正极(石墨棒):Fe3+ +e-= Fe2+ |
| C.阳极(Cu片):4OH――4e-=2H2O+O2↑ |
| D.负极(Fe钉):Fe-3e-=Fe3+ |
理论上不能用于设计成原电池的反应是
| A.2H2(g)+O2(g)==2H2O(l)△H<0 |
| B.HCl(aq)+NaOH(aq)==NaCl(aq)+H2O(l)△H<0 |
| C.2Al(s)+3Cl2(g)==2AlCl3(s)△H<0 |
| D.Zn(s)+2HCl(aq)==ZnCl2+H2(g)△H<0 |
下列有关铜锌原电池(下图)的叙述正确的是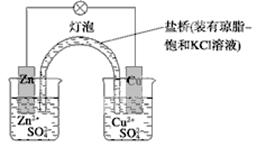
| A.正极反应为Zn-2e-===Zn2+ | B.取下盐桥,原电池仍可工作 |
| C.在外电路中,电子从正极流向负极 | D.电池反应为Zn+Cu2+===Zn2++Cu |
有关甲、乙、丙、丁四个图示的叙述正确的是
| A.甲中负极反应式为2H++2e-===H2↑ |
| B.乙中阳极反应式为Ag++e-===Ag |
| C.丙中H+向碳棒方向移动 |
| D.丁中电解开始时阳极产生黄绿色气体 |
如图由锌—铜—稀H2SO4组成的原电池装置中,当导线中有0.2 mol电子通过时,理论上两极的变化是( )
| A.铜片增重6.4g | B.锌片增重6.5 g |
| C.铜片上析出0.1 mol O2 | D.锌片溶解了6.5 g |