据报道,锌电池可能取代目前广泛使用的铅蓄电池,因为锌电池容量大,而且没有铅污染,其电池反应为2Zn+O2====2ZnO,原料为锌粒、电解质溶液和空气,则下列叙述正确的是( )
| A.锌为正极,空气进入负极反应 | B.负极反应为Zn-2e-====Zn2+ |
| C.正极发生氧化反应 | D.电解质溶液肯定不是强酸 |
(6分)在铜、银和硝酸银构成的原电池工作时,正极为__________________;当有1.6 g铜溶解时,银棒增重__________________。
关于原电池的叙述,正确的是( )
| A.任何化学反应,均可以设计成原电池 |
| B.原电池是把化学能直接转化成电能的装置 |
| C.原电池的两极必须都是金属 |
| D.原电池可以提供持续稳定的电流,应用十分广泛 |
纯锌跟稀H2SO4反应速率很小,为了加快锌的溶解和放出H2的速率,并且使产生H2的量不变,当稀H2SO4过量时,可向其中加少量( )
| A.CuSO4溶液 | B.ZnSO4 | C.铜 | D.镁条 |
2010年上海世博会,上海将有千辆氢燃料电池车上路,关于氢燃料电池下列说法不正确的是( )
| A.氢燃料电池是一种具有应用前景的绿色电源 |
| B.氢燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置 |
| C.氢燃料电池能量转换率比氢气直接燃烧高 |
| D.氢燃料电池工作时,发出淡蓝色火焰 |
由铜片、锌片与200 mL硫酸组成的原电池中,若锌片只发生电化学腐蚀,则当在铜片上共放出0.15 mol气体时,H2SO4恰好全部用完。产生这些气体消耗锌多少克?所用硫酸的物质的量浓度是多少?
2005年5月11日光明日报报道,北京研制出具有世界先进水平的锰酸锂电池所需关键材料锰酸锂(LiMn2O4)的合成新工艺,该项目的实施为北京2008年奥运电动公交车提供了100 Ah的大容量安全型锰酸锂动力电池。已知锰酸锂电池负极为金属锂,负极发生的电极反应为:_____________;电池工作时,锰酸锂中锰的化合价将____________(填“升高”或“降低”)。
下列说法中正确的是( )
| A.镍氢电池、锂离子电池和锌锰干电池都是二次电池 |
| B.燃料电池是一种高效且不会污染环境的新型电池 |
| C.化学电池的反应基础是复分解反应 |
| D.铅蓄电池放电的时候正极是Pb,负极是PbO2 |
下列叙述正确的是( )
①原电池是把化学能转变成电能的一种装置 ②原电池的正极发生氧化反应,负极发生还原反应 ③不能自发进行的氧化还原反应,通过原电池的装置可以实现 ④碳棒不能用来作原电池的正极
| A.①③ | B.①④ | C.②③④ | D.只有② |
一个原电池的总反应的离子方程式是Zn+Cu2+====Zn2++Cu,该反应的原电池的正确组成是( )
正极 负极 电解质溶液
| A. Zn Cu CuCl2 |
| B. Cu Zn CuSO4 |
| C. Zn Cu ZnCl2 |
| D. Cu Zn ZnSO4 |
(11分)铅蓄电池是典型的可充型电池,它的正负极隔板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2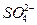
 2PbSO4+2H2O
2PbSO4+2H2O
请完成下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是__________________;电解液中H2SO4的浓度将变__________________;当外电路通过1 mol电子时,理论上负极板的质量增加_________________g。
(2)在完全放电耗尽PbO2和Pb时,若按下图连接,电解一段时间后,则在A电极上生成_________________、B电极上生成_________________,此时铅蓄电池的正负极的极性将_________________。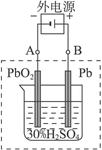
把一小块镁铝合金放入6 mol·L-1的氢氧化钠溶液中,可以形成微型电池,则该电池负极的电极反应为( )
A.Mg Mg2++2e- Mg2++2e- |
B.2Al+8OH- 2 2 +4H2O+6e- +4H2O+6e- |
C.4OH- 2H2O+O2↑+4e- 2H2O+O2↑+4e- |
D.2H2O+2e- 2OH-+H2↑ 2OH-+H2↑ |
一种新型燃料电池,一极通入空气,另一极通入C4H10气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料电池说法正确的是
①在熔融电解质中,O2-由负极移向正极 ②电池的总反应是:2C4H10+13O2====8CO2+10H2O ③通入空气的一极是正极,电极反应为:O2+4e-====2O2-
④通入C4H10的一极是正极,电极反应为:C4H10+26e-+13O2-====4CO2+5H2O( )
| A.①② | B.②③ |
| C.①③ | D.②④ |