| A.澄清石灰水中加入盐酸:Ca(OH)2+2H+==2H2O+Ca2+ |
| B.硫酸氢钠溶液中逐滴加入氧氧化钡溶液,至溶液恰好呈中性: Ba2++OH-+SO42-+H+==BaSO4↓+H2O |
| C.少量Cl2加入FeBr2溶液中:2Fe2+ +Cl2==2Fe3++2Cl- |
| D.向AlCl3溶液中滴加过量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O |
与水的离子积Kw=[H+]·[OH-]相似,FeS饱和溶液中也有离了积KSP=[Fe2+]·[S2-]。已知t℃时FeS的KSP=6.25×10-18,则t℃时饱和FeS溶液的物质的量浓度为____。又知t℃时H2S饱和溶液中[H+]2[S2-]=1.0×10-22,现将适量FeS投入H2S饱和溶液中要使[Fe2+]达到1mol·L-1,则应将溶液的pH调节到____。如已知CuS的离子积KSP=9.1×10-36,现将适量CuS放入H2S饱和溶液中,要使[Cu2+]达到0.01 mol·L-1时,应使该溶液的[H+]达到____。由此说明CuS在一般酸中能否溶解?
硫酸银的溶解度较小,25℃时,每100g水仅溶解0.836g。
(1)25℃时,在烧杯中放入 6.24克硫酸银固体,加200克水,经充分溶解后,所得饱和溶液的体积为 200mL,计算溶液中Ag+的物质的量浓度。
(2)若在上述烧杯中加入50mL0.0268 mol/LBaCl2溶液,充分搅拌,溶液中Ag+的物质的量浓度是多少?
(3)在(1)题烧杯中需加入多少L 0.0268 mol/L BaCl2溶液,才能使原溶液中Ag+浓度降低至0.0200 mol/L
下列说法正确的是( )
| A.水垢的主要成分是MgCO3和CaCO3 |
| B.硬水的软化是将全部的Mg2+、Ca2+除尽 |
| C.加入FeS、MnS以除去工业废水中的Cu2+、Cd2+、Pb2+等重金属离子 |
| D.胃舒平的主要成份是氢氧化铁,可治疗胃酸过量,同时也可补铁。 |
将AgCl分别投入下列溶液中:
①20ml 0.1mol/L的(NH4)2CO3溶液
②40ml 0.03mol/L的HCl溶液
③50ml 0.03mol/L的AgNO3溶液
④30ml 0.02mol/L的CaCl2溶液
⑤10ml 蒸馏水
⑥30ml 0.2mol/L的NH4NO3溶液
AgCl的溶解度由大到小的顺序是————
难溶化合物的饱和溶液存在着溶解平衡,例如:
AgCl(s) 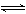 Ag++Cl—,Ag2CrO4(s)
Ag++Cl—,Ag2CrO4(s) 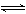 2Ag++CrO42—,在一定温度下,难溶化合物饱和溶液离子浓度的乘积为一常数,这个常数用Ksp表示。
2Ag++CrO42—,在一定温度下,难溶化合物饱和溶液离子浓度的乘积为一常数,这个常数用Ksp表示。
已知:Ksp(AgCl)=[Ag+][Cl-]=1.8×10-10
Ksp(Ag2CrO4)=[Ag+]2[CrO42-]=1.9×10-12
现有0.001摩/升AgNO3溶液滴定0.001摩/升KCl和0.001摩/升的K2CrO4的混和溶液,试通过计算回答:
(1)Cl-和CrO42-中哪种先沉淀?
(2)当CrO42-以Ag2CrO4形式沉淀时,溶液中的Cl-离子浓度是多少? CrO42-与Cl-能否达到有效的分离?(设当一种离子开始沉淀时,另一种离子浓度小于10-5mol/L时,则认为可以达到有效分离)
在图(1)所示的装置中,烧杯中盛放的是Ba(OH)2溶液,当从滴定管中逐渐加入某种溶液(A)时,溶液的导电性的变化趋势如图(2)所示。
该根据离子反应的特点分析:A溶液中含有的溶质可能是_________或__________(至少写出两种),并写出相应的离子反应的离子方程式:
________________________________、____________________________
工业上为了处理含有Cr2O72-的酸性工业废水,采用下列的处理方法:是绿矾(FeSO4·7H2O),把废水中的六价铬离子还原成三价铬离子,再加入过量的石灰水,使铬离子转变为Cr(OH)3沉淀。其主要的化学方程式如下:
H2Cr2O7+6FeSO4+6 H2SO4=Cr2(SO4)3+3Fe 2(SO4)3+7H2O
现用上述方法处理1×104L含铬(+6价)78mg/L的废水(Cr相对原子质量为52),请回答下列问题:
⑴处理后,沉淀物中除Cr(OH)3外,还有 . (用化学式表示)。
⑵需用绿矾的质量 。
FeS饱和溶液中存在溶解平衡:FeS(s) Fe2+(aq)+S2-(aq),常温下Ksp = [Fe2+]·[ S2-]=8.1×10-17 mol2/L2。由此请回答:
Fe2+(aq)+S2-(aq),常温下Ksp = [Fe2+]·[ S2-]=8.1×10-17 mol2/L2。由此请回答:
⑴理论上FeS的溶解度为 。
⑵又知FeS饱和溶液中[H+]与[ S2-]之间存在着如下关系:[H+]2·[ S2-]=1.0×10-22 mol3/L3,为了使溶液里[Fe2+]达到了1mol/L,现将FeS适量投入到其饱和溶液中,应调节溶液中的[H+]为 。
将100mL0.1mol/L的AgNO3溶液加入足量的NaCl和NaF的混合溶液中,产生1.435g沉淀,则下列说法正确的是( )
| A.产生的沉淀是AgCl |
| B.产生的沉淀是AgF |
| C.产生的沉淀是AgCl和AgF |
| D.AgF溶于水 |
CaF2的Ksp=5.3×10-9 mol3/L3,在F-浓度为3.0mol/L的溶液中,Ca2+可能的最高浓度是( )
| A.1.8×10-9 mol/L | B.1.9×10-10 mol/L |
| C.5.9×10-10 mol/L | D.5.9×10-9 mol/L |
25℃ CaCO3固体溶于水达饱和时物质的量浓度是9.327×10-5 mol/L,则CaCO3在该温度下的Ksp为( )
| A.9.3×10-5 mol/L | B.9.7×10-9 mol2/L2 |
| C.7.6×10-17 mol4/L4 | D.8.7×10-9 mol2/L2 |
5℃时,在含有大量PbI2的饱和溶液中存在平衡PbI2(s)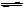 Pb2+(aq)+2I-(aq),加入KI溶液,下列说法正确的是 ( )
Pb2+(aq)+2I-(aq),加入KI溶液,下列说法正确的是 ( )
| A.溶液中Pb2+和I-浓度都增大。 | B.溶度积常数Ksp增大 |
| C.沉淀溶解平衡向左移动 | D.浓度商Qc增大 |
牙齿表面由一层硬的成分Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡:
Ca5(PO4)3OH(s) 5Ca2+(aq)+3PO43-(aq) +OH-(aq)
5Ca2+(aq)+3PO43-(aq) +OH-(aq)
进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是_______
。
已知Ca5(PO4)3F的溶解度比上面的矿化物更小,质地更坚固,请用离子方程式表示,当牙膏中配有氟化物添加剂后能防止龋齿的原因_________________________ 。
根据以上原理请你提出另外一种促进矿化的方法_______________________ 。