FeS饱和溶液中存在溶解平衡:FeS(s)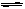 Fe2+(aq)+S2-(aq),常温下Ksp = [Fe2+]·[ S2-]=8.1×10-17 mol2/L2。由此请回答:
Fe2+(aq)+S2-(aq),常温下Ksp = [Fe2+]·[ S2-]=8.1×10-17 mol2/L2。由此请回答:
⑴理论上FeS的溶解度为 。
⑵又知FeS饱和溶液中[H+]与[ S2-]之间存在着如下关系:[H+]2·[ S2-]=1.0×10-22 mol3/L3,为了使溶液里[Fe2+]达到了1mol/L,现将FeS适量投入到其饱和溶液中,应调节溶液中的[H+]为 。
FeS饱和溶液中存在溶解平衡:FeS(s)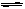 Fe2+(aq)+S2-(aq),常温下Ksp = [Fe2+]·[ S2-]=8.1×10-17 mol2/L2。由此请回答:
Fe2+(aq)+S2-(aq),常温下Ksp = [Fe2+]·[ S2-]=8.1×10-17 mol2/L2。由此请回答:
⑴理论上FeS的溶解度为 。
⑵又知FeS饱和溶液中[H+]与[ S2-]之间存在着如下关系:[H+]2·[ S2-]=1.0×10-22 mol3/L3,为了使溶液里[Fe2+]达到了1mol/L,现将FeS适量投入到其饱和溶液中,应调节溶液中的[H+]为 。