(原创) 酸、碱、盐均属于电解质,它们的水溶液中存在各种平衡。
(1) 氨水是中学常见碱
① 下列事实可证明氨水是弱碱的是 (填字母序号)。
A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
B.常温下,0. 1 mol·L-1氨水pH为11
C.铵盐受热易分解
D.常温下,0. 1mol·L-1氯化铵溶液的pH为5
② 下列方法中,可以使氨水电离程度增大的是 (填字母序号)。
A.通入氨气 B.加入少量氯化铁固体
C.加水稀释 D.加入少量氯化铵固体
(2)盐酸和醋酸是中学常见酸
用0.1 mol·L-1NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
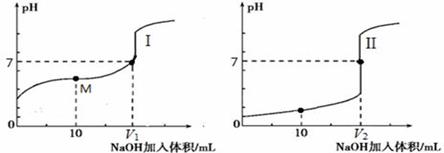
① 滴定醋酸的曲线是 (填“I”或“II”)。
② 滴定开始前,三种溶液中由水电离出的c(H+)最大的是 。
③V1和V2的关系:V1 V2(填“>”、“=”或“<”)。
④ M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是
(3)为了研究难溶盐的沉淀溶解平衡和沉淀转化,某同学设计如下实验。
| 步骤1:向2 mL 0.005 mol·L-1AgNO3溶液中加入2 mL 0.005 mol·L-1 KSCN溶液,静置。 |
出现白色沉淀。 |
| 步骤2:取1 mL上层清液于试管中,滴加1滴2 mol·L-1Fe(NO3)3溶液。 |
溶液变为红色。 |
| 步骤3:向步骤2的溶液中,继续加入5滴 3 mol·L-1 AgNO3溶液。 |
现象a ,溶液红色变浅。 |
| 步骤4:向步骤1余下的浊液中加入5滴 3 mol·L-1 KI溶液。 |
出现黄色沉淀。 |
已知:ⅠAgSCN是白色沉淀。
Ⅱ相同温度下,Ksp(AgI)= 8.3×10‾17,Ksp (AgSCN )= 1.0×10‾12 。
① 步骤3中现象a是 。
② 用沉淀溶解平衡原理解释步骤4的实验现象 。
③向50 mL 0.005 mol•L‾1的AgNO3溶液中加入150 mL0.005 mol•L‾1的 KSCN溶液,混合后溶液中Ag+的浓度约为 mol•L‾1。(忽略溶液体积变化)
铁铜单质及其化合物的应用范围很广。现有含氯化亚铁杂质的氯化铜晶体,为制取纯净的CuCl2•2H2O,首先将其制成水溶液,然后按照如图步骤进行提纯:

已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
| |
Fe3+ |
Fe2+ |
Cu2+ |
| 开始沉淀的pH |
1.9 |
7.0 |
4.7 |
| 完全沉淀的pH |
3.2 |
a |
6.7 |
请回答下列问题:
(1)化学上通常认为残留在溶液中的离子浓度小于1×10﹣5mol/L时,沉淀就达到完全。已知Fe(OH)2的Ksp约为1.0×10﹣15,则a= 。
(2)加入氧化剂的目的是 ,X应选择 。
A.K2Cr2O7 B.浓HNO3 C.H2O2 D.KMnO4
(3)加入的物质Y是 。
(4)设计实验从溶液Ⅲ中获得纯净的CuCl2•2H2O。简要描述实验步骤 。
(1)下列物质中能导电的是 ,属于强电解质的是 ,
①H2SO4,②熔融硫酸钠,③ NH3•H2O,④ CO2,⑤碳酸钙,⑥ CH3COOH,⑦氯气,⑧石墨.
(2)某温度下,将50mL 0.2mol/L MgCl2溶液与50mL 0.2 mol/LNaOH溶液充分混合。经判断: (选填有或无)沉淀生成,依据是 (已知此温度下KSP[Mg(OH) 2]=1.8 10
10 )
)
(3)常温下,0.lmol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO32-)(填“>”、“=或“<”),原因是 (用恰当的化学用语和必要的文字说明回答)。
研究硫元素及其化合物的性质具有重要意义。
(1)①硫离子的结构示意图为 。
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为 。
(2)25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如右图(忽略溶液体积的变化、H2S的挥发)。

①pH=13时,溶液中的c(H2S)+c(HS-)= mol·L-1.
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH= 时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如右表。
| |
Ka1 |
Ka2 |
| H2SO3 |
1.3×10-2 |
6.3×10-4 |
| H2CO3 |
4.2×10-7 |
5.6×10-11 |
①HSO3-的电离平衡常数表达式K= 。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为 。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为 。
在MgCl2和AlCl3的混和溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的物质的量和所得沉淀的物质的量的关系如右图所示,则:

(1)图中C点表示当加入 mol NaOH时,Al3+已完全转化为 (填微粒符号)
(2)图中线段OA和AB两段NaOH的物质的量之比为 。
沉淀滴定和中和滴定的原理相同,如用AgNO3溶液滴定溶液中的Cl-的含量时常以CrO为指示剂,这是因为AgCl的溶解度比Ag2CrO4的溶解度________的缘故(填“大”或“小”),其实难溶性银盐较多,溶度积如下表:
| 银盐 性质 |
AgCl |
AgI |
AgCN |
Ag2CrO4 |
AgSCN |
| 沉淀颜色 |
白 |
黄 |
白 |
砖红 |
白 |
| 溶度积: |
1.8×10-10 |
8.3×10-17 |
1.2×10-10 |
1.2×10-12 |
1.0×10-12 |
若用AgNO3去滴定KSCN溶液,可选用为滴定的合适指示剂有( )
A.NaCl B.KI C.NaCN D.Na2CrO4
刚好达到滴定终点时,发生的离子反应方程式为______________________。
(1)己知Na2SO3溶液中存在水解平衡:SO32﹣+H2O HSO3﹣+OH﹣,请用Na2SO3溶液及必要的实验用品,设计简单实验,证明盐类的水解是一个吸热过程.必需的试剂有 ;操作和 现象是 。
HSO3﹣+OH﹣,请用Na2SO3溶液及必要的实验用品,设计简单实验,证明盐类的水解是一个吸热过程.必需的试剂有 ;操作和 现象是 。
(2)已知等物质的量浓度的醋酸和醋酸钠溶液等体积混合呈酸性是因为醋酸的电离常数 醋酸钠的水解常数(选填“大于”、“小于”或“等于”);可知该温度下醋酸钠(或醋酸根)的水解常数______ 1.0×10-7 (选填“大于”、“小于”或“等于”)
铁及其化合物与生活密切相关,古代炼丹家以绿矾(FeSO4·7H2O为原料,放在炼丹炉中锻烧可制得绿矾油。绿矾油是一种无色粘稠液体,可用于除掉兵器上的铁锈。右图是2. 78 g绿矾隔绝空气受热分解时,所得固体产物的质量随温度变化的曲线。将加热产生的所有气体通入足量的BaCl2溶液.得自色沉淀1.16g。


(1)绿矾油主要成份的化学式为 。t1~t2.发生反应的化学方程式为 。
(2)若将28.8 g草酸亚铁(FeC2O4)隔绝空气加热至100℃,得到14.4 g黑色细粉,则可推知该黑色细粉为 。
(3)以下是FeSO4·7H2O的实验室制备流理图

根据题意完成下列填空:
①反应II需要100 mL1. 5 mol·L-1的稀H2SO4溶解洁净的铁屑,用质量分数为98%、密度为1. 84 g·cm -3的浓H2SO4配制。所用的仪器有量筒、烧杯、玻璃捧、胶头滴管及 。
②操作A的名称为 。
③测定FeSO4·7H2O产品中Fe2+含量的常用方法是KMnO4溶液滴定法。已知称取6.0 g FeSO4·7H2O产品,配制成溶液,用硫酸酸化的0.2000 mol·L -1KMnO4溶液滴定,消耗KMnO4溶液的体积为20. 00 mL。发生反应的离子方程式为 ,计算上述样品中FeSO4·7H2O的质量分数为 (保留两位有效数字)。
Cl2及其化合物在生产、生活中具有广泛的用途

(1)25℃时将氯气溶于水形成氯气-氯水体系,该体系中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图1所示。
①已知HClO的杀菌能力比ClO-强,由图分析,用氯气处理饮用水时,pH=7.5与 pH=6时杀菌效果强的是__________。
②氯气-氯水体系中,存在多个含氯元素的平衡关系,分别用平衡方程式表示为____________。
(2)ClO2是一种新的消毒剂,工业上可用Cl2氧化NaClO2溶液制取ClO2,写出该反应的化学方程式____________。
(3)工业上还可用下列方法制备ClO2,在80℃时电解氯化钠溶液得到NaClO3,然后与盐酸反应得到ClO2。电解时,NaClO3在_____极(填阴或阳)生成,生成ClO3–的电极反应式为__________________。
(4)一定条件下,在水溶液中 1 mol Cl–、1mol ClOx–(x=1,2,3,4)的能量大小与化合价的关系如图2所示
①从能量角度看,C、D、E中最不稳定的离子是 (填离子符号)。
②B → A + D反应的热化学方程式为 (用离子符号表示)。
已知下列物质在20 ℃下的Ksp如下,试回答下列问题
(1)20 ℃时,上述五种银盐饱和溶液中,Ag+物质的量浓度由大到小的顺序是__________________;
(2)向浓度均为0.1mol/L的KCl和KBr混合溶液中加入足量AgNO3溶液,当两种沉淀共存时, =________________。
=________________。
(3)向AgBr的饱和溶液中加入Na2S溶液,反应的离子方程式是______________。该反应的平衡常数表达式是:_____________。
(4)测定水体中氯化物含量,常用标准硝酸银法进行滴定,滴定时应加入的指示剂______________。
| A.KBr | B.KI | C.K2S | D.K2CrO4 |
氮及其化合物在生产、生活中有着重要作用,减少氮氧化物的排放是环境保护的重要内容之一,请回答下列氮及其化合物的相关问题:
(1)N4的分子结构与白磷分子的正四面体结构相似。已知断裂1mol N-N键吸收167kJ热量,生成1mol N≡N键放出942kJ热量,请写出N4气体转变为N2反应的热化学方程式: 。
(2)NH3可直接用作车用燃料电池,产物无污染。写出碱性介质下该电池负极的电极反应式: 。
(3)在T1℃时,将5mol N2O5置于10L固定容积的密闭容器中发生下列反应:2N2O5(g)  4NO2(g)+O2(g);△H>0;反应至5分钟时各物质的浓度不再发生变化,测得NO2的体积分数为50%。
4NO2(g)+O2(g);△H>0;反应至5分钟时各物质的浓度不再发生变化,测得NO2的体积分数为50%。
①T1℃时该反应的平衡常数K的计算式为 。
②用O2表示从0~5min内该反应的平均速率υ(O2) = 。
③将上述平衡体系的温度降至T2℃,密闭容器内减小的物理量有 。
A.压强 B.密度 C.反应速率 D.N2O5的浓度
(4)在恒温恒容的密闭容器中充入NO2,建立如下平衡:2NO2(g)  N2O4(g),平衡时N2O4与NO2的物质的量之比为a,其它条件不变的情况下,分别再充入NO2和再充入N2O4,平衡后引起的变化正确的是 。
N2O4(g),平衡时N2O4与NO2的物质的量之比为a,其它条件不变的情况下,分别再充入NO2和再充入N2O4,平衡后引起的变化正确的是 。
A.都引起a减小
B.都引起a增大
C.充入NO2引起a减小,充入N2O4引起a增大
D.充入NO2引起a增大,充入N2O4引起a减小
(5)25℃时,NH3·H2O电离常数Kb=1.8×10-5,Mg(OH)2的溶度积常数Ksp=1.8×10-11,用pH计测得0.5 mol·L一1氨水溶液的pH约为 。在某氯化镁溶液中加入一定量某浓度的氨水后,测得混合液pH =11.0,则此温度下残留在溶液中的c(Mg2+)= 。(已知lg2≈0.3、lg3≈0.5)。
硫的化合物在科研、生活及化学工业中具有重要的应用。
(1)在废水处理领域中,H2S或Na2S能使某些金属离子生成极难溶的硫化物而除去。25℃,在0.10 mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如下表(忽略溶液体积的变化、H2S的挥发)。
| pH |
3 |
5 |
7 |
9 |
11 |
| c(S2-)/ mol•L-1 |
1.4×10-15 |
1.4×10-11 |
6.8×10-8 |
1.3×10-5 |
1.3×10-3 |
某溶液含0.020 mol•L-1Mn2+、0.1 mol•L-1H2S,当溶液的pH=5时,Mn2+开始沉淀,则MnS的溶度积=________________。
(2)工业上采用高温分解H2S制取氢气,其反应为2H2S(g) 2H2(g)+S2(g) △H1,在膜反应器中分离出H2。
2H2(g)+S2(g) △H1,在膜反应器中分离出H2。
①已知:H2S(g) H2(g)+S(g) △H2,2S(g)
H2(g)+S(g) △H2,2S(g) S2(g)△H3。则△H1=_______(用含△H2、△H3的式子表示。
S2(g)△H3。则△H1=_______(用含△H2、△H3的式子表示。
②在密闭容器中,充入0.10molH2S(g),发生反应2H2S(g) 2H2(g)+S2(g),控制不同的温度和压强进行实验。结果如图所示。
2H2(g)+S2(g),控制不同的温度和压强进行实验。结果如图所示。
图中压强p1、p2、p3由大到小的顺序为_______________,理由是_________________。若容器的容积为2.0L,则压强为p3,温度为950℃时,反应经3h达到平衡,则达到平衡时v(S2)=__________;若压强p2=7.2MPa,温度为975℃时,该反应的平衡常数Kp=_____________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数),若保持压强不变,升温到1000℃时,则该反应的平衡常数___________(填“增大”“不变”或“减小”)。
(3)工业上用惰性电极电解KHSO4饱和溶液制取H2O2,示意图如图所示:
①低温电解饱和KHSO4溶液时阳极的电极反应式为_________________。
②K2S2O8水解时生成H2O2和KHSO4,该反应的化学方程式为_________________。
(1)有浓度均为0.1 mol•L-1的 ①盐酸 ②硫酸 ③醋酸三种溶液,请用序号填空: 三种溶液的c(H+)大小顺序为 ;中和一定量NaOH溶液生成正盐时,需上述三种酸的体积依次的大小关系为 ;若三种溶液的pH都为2,分别取10mL上述溶液加水稀释至1000mL,此时三种溶液的pH的大小关系为 。
(2)25℃时,AgCl的Ksp=1.8×10-10 ,试写出AgCl溶解平衡的表达式: ,现将足量AgCl固体投入100mL0.1mol/L MgCl2溶液充分搅拌后冷却到25℃时,此时c(Ag+)= mol/L(忽略溶液体积的变化)。
(1)将标况下的2.24LCO2通入150mL 1mol•L-1NaOH溶液中,溶液中离子浓度由大到小的顺序为
(2)0.02mol/L的醋酸溶液与0.01mol/L的氢氧化钠溶液等体积混合,混合后溶液的pH=6,则溶液中除水分子外粒子浓度(含CH3COOH)由大到小的顺序为 ,溶液中c(CH3COO—)-c(Na+)= (写出精确计算结果)
已知25℃时Ksp[Mg(OH)2]=1.0×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(3)在25 ℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式)。
(4)室温时,Mg(OH)2(S) Mg2+(aq)+2OH-(aq) 当Mg2+沉淀完全(离子浓度小于10-5mol/L)时,溶液的pH=_______。
Mg2+(aq)+2OH-(aq) 当Mg2+沉淀完全(离子浓度小于10-5mol/L)时,溶液的pH=_______。
I.氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1 mol·L-1的氨水中加入少量的NH4Cl固体,溶液的PH (填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度 (填“增大”或“减小”)。
(2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;
Ⅱ.25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-) 关系如右图(忽略溶液体积的变化、H2S的挥发)。

①pH=13时,溶液中的c(H2S)+c(HS-)= mol·L-1.
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH= 时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]