25℃,两种酸的电离常数如下表。
| |
Ka1 |
Ka2 |
| H2A |
1.3×10-2 |
6.3×10-6 |
| H2B |
4.2×10-7 |
5.6×10-7 |
下列叙述中正确的是
A.H2A的电离方程式:H2A=2H++A2-
B.常温下,在水中Na2B的水解平衡常数为: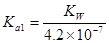
C.等浓度的Na2A和Na2B溶液,由水电离产生的H+浓度大小关系为:前者大于后者
D.向Na2B溶液中加入少量H2A溶液,可发生反应:B2-+H2A=A2-+H2B
在25℃时,FeS的Ksp=6.3×10-18,CuS的Ksp=1.3×10-36,ZnS的Ksp=1.3×10-24.下列有关说法中正确的是( )
| A.25℃时,CuS的溶解度大于ZnS的溶解度 |
| B.25℃时,向含有等物质的量的FeCl2和CuCl2的混合液中逐滴加入Na2S,最先出现沉淀的是FeS |
| C.除去ZnCl2溶液中的Cu2+,可以选用FeS作沉淀剂 |
D.将足量CuSO4溶解在0.1mol/L的H2S溶液中,S2-能达到的最大浓度为 |
某温度时,BaSO4在水中的沉淀溶解平衡曲线如下图所示。下列说法正确的是( )

提示:BaSO4(s) Ba2+(aq)+SO42-(aq)的平衡常数Ksp=c(Ba2+)·c(SO42-),称为溶度积常数。
Ba2+(aq)+SO42-(aq)的平衡常数Ksp=c(Ba2+)·c(SO42-),称为溶度积常数。
| A.加入Na2SO4可以使溶液由a点变到b点 |
| B.通过蒸发可以使溶液由d点变到c点 |
| C.d点无BaSO4沉淀生成 |
| D.a点对应的Ksp大于c点对应的Ksp |
已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13 ,Ksp(Ag2CrO4)=9×10-11。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010 mol/L,向该溶液中逐滴加入0.010 mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为 ( )
| A.Cl-、Br-、CrO42- | B.CrO42-、Br、Cl- |
| C.Br-、Cl-、CrO42- | D.Br、CrO42-、Cl- |
下图所示与对应叙述相符的是( )
A.一定条件下,X和Y反应生成Z,由图1推出该反应的方程式可表示为:X + 3Y Z Z |
| B.图2表示NaOH溶液滴加到0.1 mol/L的一元酸溶液得到的滴定曲线(常温下),该实验最好选取酚酞作指示剂 |
| C.常温下,向NaOH溶液中逐滴加入等浓度的醋酸溶液,所得滴定曲线如图3所示。当7<pH<13时,溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D.用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均可以与Ag+反应生成沉淀),由图4可确定首先沉淀的是C- |
已知下表数据:
| 物质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
| 完全沉淀时的pH范围 |
≥9.6 |
≥6.4 |
≥3 |
对于含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液,下列说法正确的是
A.向该混合溶液中逐滴加入NaOH溶液,最先看到的是红褐色沉淀
B.该溶液中c(SO42﹣):[c(Cu2+)+c(Fe2+)+c(Fe3+)]==5:4
C.向该溶液中加入适量氯水,调节pH到4~5后过滤,可获得纯净的CuSO4溶液
D.向该溶液中加入适量氨水,调节pH到9.6后过滤,将所得沉淀灼烧,可得等物质的量的CuO、FeO、Fe2O3三种固体的混合物
用右图所示装置进行相应的实验,能达到实验目的或得出相应结论的是
| |
① |
② |
③ |
实验结论或目的 |
 |
| A |
浓盐酸 |
KMnO4 |
石蕊试液 |
氯气的水溶液有酸性、漂白性 |
|
| B |
稀硫酸 |
Na2S |
AgNO3与AgCl的浊液 |
Ksp(AgCl)>Ksp(Ag2S) |
|
| C |
硝酸 |
Na2CO3溶液 |
Na2SiO3溶液 |
比较硝酸、碳酸、硅酸酸性强弱 |
|
| D |
溴水 |
FeBr3、苯 |
AgNO3溶液 |
苯和溴水能发生取代反应 |
25℃时,在含有大量的PbI2饱和溶液中存在平衡:PbI2(s) Pb2+(aq)+2I-(aq),向其中加入KI固体,下列说法正确的是 ( )
Pb2+(aq)+2I-(aq),向其中加入KI固体,下列说法正确的是 ( )
| A.溶液中Pb2+和I-浓度都增大 | B.溶度积常数Ksp增大 |
| C.沉淀溶解平衡向逆向移动 | D.PbI2的溶解度不变 |
硫酸锌是制造锌钡白和锌盐的主要原料,也可用作印染媒染剂,医药上用于催吐剂。已知25 ℃时,Ksp[Zn(OH)2]=1.0×10-17, Ksp[Ag2SO4]=1.2×10-5,则下列说法正确的是
| A.在水中加入少量ZnSO4固体时,水的电离平衡向正反应方向移动, Kw减小 |
| B.在ZnSO4溶液中各离子的浓度关系为:c(Zn2+)+c(H+)=c(OH-)+c(SO42-) |
| C.在0.5 L 0.10 mol·L-1的ZnSO4溶液中加入等体积的0.02 mol·L-1的AgNO3溶液,即可生成Ag2SO4沉淀 |
| D.常温下,要除去0.20 mol·L-1 ZnSO4溶液中的Zn2+,至少要调节pH≥8 |
下列实验对应的现象及结论均正确且两者具有因果关系的是
| 选项 |
实验 |
现象 |
结论 |
| A |
SO2通入BaCl2溶液,然后滴入稀硝酸 |
白色沉淀,白色沉淀不溶于稀硝酸 |
所得沉淀为BaSO3,后转化为BaSO4 |
| B |
浓硫酸滴入蔗糖中,并搅拌 |
得黑色蓬松的固体并有刺激性气味气体 |
该过程中浓硫酸仅体现吸水性和脱水性 |
| C |
向FeCl2溶液中加入足量Na2O2粉末 |
出现红褐色沉淀和无色气体 |
FeCl2溶液部分变质 |
| D |
向足量含淀粉的FeI2溶液中滴加2滴氯水 |
溶液变蓝 |
还原性:I->Fe2+ |
已知PbI2的Ksp=7.0×10-9,将7.5×10-3 mol/L的KI与一定浓度的Pb(NO3)2溶液按2∶1体积混合,则生成PbI2沉淀所需Pb(NO3)2溶液的最小浓度为
| A.8.4×10-4 mol/L | B.5.6×10-4 mol/L |
| C.4.2×10-4 mol/L | D.2.8×10-4 mol/L |
已知:25 ℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp(MgF2)=7.42×10-11。下列说法正确的是
| A.25 ℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B.25 ℃时,Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 |
| C.25 ℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL 0.01 mol·L-1 NH4Cl溶液中的Ksp小 |
| D.25 ℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化成为MgF2 |
现将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的顺序是
①20 mL 0.01 mol·L-1 KCl溶液 ②30 mL 0.02 mol·L-1 CaCl2溶液 ③40 mL 0.03 mol·L-1 HCl溶液
| A.①>②>③ | B.①>③>② | C.②>①>③ | D.③>②>① |
在BaSO4饱和溶液中加入少量的BaCl2溶液,产生BaSO4沉淀,若以Ksp表示BaSO4的溶度积常数,则平衡后溶液中
| A.c(Ba2+)=c(SO42-)=(Ksp)1/2 |
| B.c(Ba2+)·c(SO42-)>Ksp,c(Ba2+)=c(SO42-) |
| C.c(Ba2+)·c(SO42-)=Ksp,c(Ba2+)>c(SO42-) |
| D.c(Ba2+)·c(SO42-)≠Ksp,c(Ba2+)<c(SO42-) |
下列说法正确的是
| A.反应CaCO3(s)=CaO(s)+CO2(g),在常温下不能自发进行,则该反应的△H<0 |
B.0.lmol·L一1CH3COOH溶液加水稀释后,溶液中 的值减小 的值减小 |
| C.铅蓄电池在放电过程中,负极质量增加,正极质量减少 |
| D.锅炉中沉积的CaSO4和BaSO4都可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 |