要使工业废水中的金属Pb2+离子沉淀,可用硫酸盐.碳酸盐.硫化物等作沉淀剂,已知Pb2+离子与这些离子形成的化合物的溶解度如下:
| 化合物 |
PbSO4 |
PbCO3 |
PbS |
| 溶解度/g |
1.03×10-4 |
1.81×10-7 |
1.84×10-14 |
由上述数据可知,选用的沉淀剂最好的是( )
| A.硫化物 | B.硫酸盐 | C.碳酸盐 | D.以上沉淀剂均可 |
AgCl和Ag2CrO4的溶度积分别为1.8×10-10mol2/L2和2.0×10-12mol3/L3,若用难溶盐在溶液中的浓度来表示其溶解度,则下面的叙述正确的是 ( )
| A.两者的溶解度相等 |
| B.前者的溶解度大于后者 |
| C.两者的类型不同,不能由Ksp的大小直接判断溶解能力大小 |
| D.都是难溶盐,溶解度无意义 |
在BaSO4饱和溶液中加入少量氯化钡溶液产生沉淀,若以Ksp表示BaSO4的溶度积常数,则平衡后溶液中( )
| A.[Ba2+]=[SO42-]=(Ksp)1/2 |
| B.[Ba2+]·[SO42-]>Ksp,[Ba2+]=[SO42-] |
| C.[Ba2+]·[SO42-]=Ksp,[Ba2+]>[SO42-] |
| D.[Ba2+]·[SO42-]≠Ksp,[Ba2+]<[SO42-] |
工业废水中常含有Cu2+.Cd2+.Pb2+等重金属离子,可通过加入过量的难溶电解质FeS.MnS,使这些金属离子形成硫化物沉淀除去。依据以上事实,可推知FeS.MnS具有的相关性质是( )
| A.在水中的溶解能力大于CuS.CdS.PbS |
| B.在水中的溶解能力小于CuS.CdS.PbS |
| C.在水中的溶解能力与CuS.CdS.PbS相同 |
| D.二者均具有较强的吸附性 |
实验室中,要使AlCl3溶液中的Al3+全部沉淀出来,最适宜选择的试剂是( )
| A.NaOH溶液 | B.Ba(OH)2溶液 | C.盐酸 | D.氨水 |
有100mL MgCl2和AlCl3的混合溶液,其中[Mg2+]=0.2mol/L,[Cl-]="1.3" mol/L。要使完全转化为Mg(OH) 2且与Al3+ 恰好分开,至少需要2 mol/L的NaOH溶液的体积为( )
| A.80mL | B.100mL | C.120mL | D.140m |
下列对沉淀溶解平衡的描述正确的是 ( )
| A.反应开始时,溶液中各离子浓度相等 |
| B.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等 |
| C.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变 |
| D.沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解 |
已知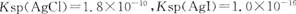 。下列关于不溶物之间转化的说法中正确的是 ( )
。下列关于不溶物之间转化的说法中正确的是 ( )
A.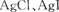 两者都不溶于水,因此AgCl与AgI不能相互转化 两者都不溶于水,因此AgCl与AgI不能相互转化 |
B.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于 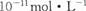 |
| C.一定条件下AgCl可以转化为更难溶的AgI |
| D.只能由Ksp较大的不溶物转化为Ksp较小的不溶物 |
下列说法不正确的是
A.BaCrO4(s)  Ba2+(aq)+ CrO42-(aq)的平衡体系中,加入BaCl2浓溶液沉淀量增多 Ba2+(aq)+ CrO42-(aq)的平衡体系中,加入BaCl2浓溶液沉淀量增多 |
| B.pH=2的酸溶液与pH=12的强碱溶液等体积混合,所得溶液pH≤7 |
C.苯酚显色原理为:6C6H5OH+Fe3+ Fe(C6H5O)63-(紫色)+6H+,则检验水杨酸( Fe(C6H5O)63-(紫色)+6H+,则检验水杨酸( )中的酚羟基,需加入适量的小苏打溶液后,再加入氯化铁溶液 )中的酚羟基,需加入适量的小苏打溶液后,再加入氯化铁溶液 |
| D.某试液中加入盐酸酸化的氯化钡溶液有白色淀淀,该试液中一定含有SO42- |
2007年诺贝尔化学奖获得者德国科学家格哈德·埃特尔在表面化学研究领域作出了开拓性贡献。化学家将研究气体与固体(或液体)在界面上所发生的物理化学现象的科学称为表面化学。对下列现象的研究不属于表面化学范畴的是
| A.氯化银在水中的溶解平衡 | B.氢氧燃料电池中电极上的反应 |
| C.铁在潮湿的空气中生锈 | D.氮气与氢气在铁触媒作用下化合 |