下表是不同温度下水的离子积数据:
| 温度/℃ |
25 |
t1 |
t2 |
| Kw/ mol2·L-2 |
1×10-14 |
a |
1×10-12 |
试回答以下几个问题:
(1)若25< t1< t2,则a 1×10-14(填“<”、“>”或“=”),由此判断的理由是:
(2)在25 ℃下,pH=10的NaOH溶液中,水电离产生的[OH-]为:
(3)若某温度下,纯水中c(H+) = 5×10-7 mol·L-1,则此时纯水中的c(OH-)=_______________;若温度不变,滴入稀硫酸使c(H+)=5.0×10-3 mol·L-1,则c(OH-)=_______________。
把Ca(OH)2放入蒸馏水中,一段时间后达到如下平衡:Ca(OH)2(固) Ca2++2OH-,下列说法正确的是( )
Ca2++2OH-,下列说法正确的是( )
| A.给溶液加热,溶液的pH升高 |
| B.恒温下向溶液中加入CaO,溶液的pH升高 |
| C.向溶液中加入Na2CO3溶液,则其中Ca(OH)2的固体增多 |
| D.向溶液中加入少量CH3COONa晶体,则其中Ca(OH)2的固体增多 |
下列有关沉淀溶解平衡的说法中,正确的是( )
A. Ksp(AB2)小于Ksp(CD),说明AB2的溶解度小于CD的溶解度
B.在氯化银的沉淀溶解平衡体系中加入蒸馏水,氯化银的Ksp增大
C.在碳酸钙的沉淀溶解平衡体系中加入稀盐酸,沉淀溶解平衡不移动
D.向氯化银沉淀溶解平衡体系中加人碘化钾固体,氯化银沉淀可转化为碘化银沉淀
将①H+、②Cl-、③Al3+、④K+、⑤S2-、⑥OH-、⑦NO3-、⑧NH4+分别加入H2O中,基本上不影响水的电离平衡的离子是( )
已知AgCl(s) Ag+ + Cl-,平衡时,c(Ag+)·c(C-)="Ksp" ,过量氯化银分别投入①100 mL水 ②24 mL 0.1 mol·L-1NaCl ③10 mL 0.1 mol·L-1MgCl2 ④30 mL 0.1 mol·L-1AgNO3溶液中,溶液中c(Ag+)大小顺序为
Ag+ + Cl-,平衡时,c(Ag+)·c(C-)="Ksp" ,过量氯化银分别投入①100 mL水 ②24 mL 0.1 mol·L-1NaCl ③10 mL 0.1 mol·L-1MgCl2 ④30 mL 0.1 mol·L-1AgNO3溶液中,溶液中c(Ag+)大小顺序为
| A.③①②④ | B.④①②③ | C.①②③④ | D.④③②① |
已知在25℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36,常温时下列有关说法正确的是
| A.向H2S的饱和溶液中通入少量SO2气体溶液的酸性增强 |
| B.将足量的CuSO4溶解在0.1 mol/L的H2S溶液中,溶液中Cu2+的最大浓度为 1.3×10-35 mol/L |
| C.因为H2SO4是强酸,所以反应:CuSO4+H2S===CuS↓+H2SO4不能发生 |
| D.除去工业废水中的Cu2+可以选用FeS作沉淀剂 |
把足量熟石灰放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s) 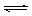 Ca2+(aq)+2OH-(aq),下列叙述正确的是( )
Ca2+(aq)+2OH-(aq),下列叙述正确的是( )
| A.给溶液加热,溶液的pH升高 |
| B.恒温下向溶液中加入CaO,溶液的pH升高 |
| C.向溶液中加入NaCO3溶液,则其中的Ca(OH)2的固体增 |
| D.向溶液中加入少量的NaOH固体,则其中的Ca(OH)2的固体增多 |
在溶液中有浓度均为0.01mol·L-1的Fe3+、Cr3+、Zn2+、Mg2+等离子,已知:
当氢氧化物开始沉淀时,下列哪一种离子所需溶液的pH最大
| A.Cr3+ | B.Fe3+ | C.Zn2+ | D.Mg2+ |
在温度t1和t2下,X2(g)和H2反应生成HX的平衡常数如下表:
下列说法正确的是
| A.在相同条件下随着卤素原子核电荷数的增加,平衡时X2的转化率逐渐降低 |
| B.t2>t1,HX的生成反应是吸热反应 |
| C.随着卤素原子核电荷数的增加HX的还原性逐渐减弱 |
| D.随着卤素原子核电荷数的增加HX的稳定性逐渐增强 |
已知:
①25℃时弱电解质电离平衡数:Ka(CH3COOH)=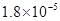 ,Ka(HSCN)=0.1,
,Ka(HSCN)=0.1,
难溶电解质的溶度积常数:Kap(CaF2)=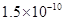
②25℃时,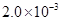 mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示: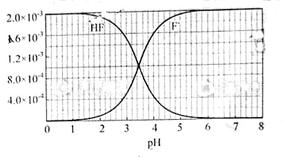
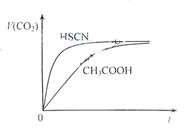
请根据以下信息回答下旬问题: 图2
(1)25℃时,将20mL 0.10 mol·L-1 CH3COOH溶液和20mL 0.10 mol·L-1HSCN溶液分别与20mL 0.10 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示:
反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是 。反应结束后所得两溶液中,c(CH3COO-) c(SCN-)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka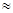 ,列式并说明得出该常数的理由 。
,列式并说明得出该常数的理由 。
(3)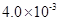 mol·L-1HF溶液与
mol·L-1HF溶液与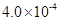 mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),
mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化), 通过列式计算说明是否有沉淀产生。
通过列式计算说明是否有沉淀产生。
(是,否)有沉淀产生
列式计算(过程):
在25℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最后生成黑色沉淀。下列叙述不正确的是
| A.溶度积小的沉淀可以转化为溶度积更小的沉淀 |
| B.若先加入Na2S溶液,再加入KI溶液,则无黄色沉淀产生 |
| C.25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同 |
| D.25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解度不同 |
已知在25℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36。常温时下列说法正确的是
| A.向H2S的饱和溶液中通入少量SO2气体,溶液的酸性增强 |
| B.将足量的CuSO4溶解在0.1 mol/L的H2S溶液中,溶液中Cu2+的最大浓度为1.3×10-35 mol/L |
| C.因为H2SO4是强酸,所以反应CuSO4+H2S=CuS↓+H2SO4不能发生 |
| D.除去工业废水中的Cu2+可以选用FeS作沉淀剂 |
30℃时等质量的两 份饱和石灰水,一份冷却到10℃,另一份加入少量氧化钙并保持温度仍是30℃,这两种情况下都不改变的是
份饱和石灰水,一份冷却到10℃,另一份加入少量氧化钙并保持温度仍是30℃,这两种情况下都不改变的是
| A.溶液的质量 | B.氢氧化钙的溶解度 |
| C.溶液中钙离子的数目 | D.溶液中钙离子的物质的量浓度 |
(1)某温度(t℃)时,测得0.01 mol·L-1 的NaOH溶液的pH=13,请回答下列问题:
①该温度下水的Kw= 。
②此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合(忽略体积变化),若所得混合液为中性,且a=12,b=2,则Va︰Vb= 。
(2)已知25°C时Ksp(Mg(OH)2)=1.8×10-11,为除去某食盐溶液中的Mg2+,可用NaOH为除杂试剂,当控制溶液PH=12时,可确保Mg2+除尽,此时溶液中Mg2+的物质的量浓度为 .